题目内容
3.下列说法正确的( )| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
分析 A、依据n=$\frac{m}{M}$计算物质的量,溶液体积大于1L;
B、标准状态下,水不是气体,是液体;
C、22.4LO2的物质的量和温度压强有关系,根据V=nVm来计算即可;
D、根据n=$\frac{V}{Vm}$可结合分子的组成分析计算即可.
解答 解:A、80g NaOH固体计算氢氧化钠物质的量,n=$\frac{m}{M}$=2mol,溶液体积大于1L,80g NaOH固体溶于1L水中,所得NaOH溶液的物质的量浓度小于2mol•L-1,故A错误;
B、标准状态下,水不是气体,是液体,18gH2O在标准状况下的物质的量不是1mol,体积不是22.4L,故B错误;
C、只有标准状况下,22.4L即1molO2中含有6.02×1023个氧分子,故C错误;
D、由n=$\frac{V}{Vm}$可知,两种气体的物质的量分别为$\frac{0.02L}{22.4L/mol}$、$\frac{0.06L}{22.4L/mol}$,则原子的物质的量之比为($\frac{0.02L}{22.4L/mol}$×4):($\frac{0.06L}{22.4L/mol}$×2)=2:3,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析应用,学会质量、物质的量、微粒数之间的计算,掌握基础是关键,题目较简单.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
13.25℃时,pH=13的氨水溶液,下列说法不正确的是( )
| A. | 溶液中C(OH-)=0.1mol•L-1 | B. | 溶液中C(OH-)>C(H+) | ||
| C. | 该氨水的浓度为0.1mol•L-1 | D. | 溶液中水的离子积为1×10-14 |
14.常温下,对于0.1mol•L-1的氨水,下列说法正确的是( )
| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
18.有A、B、C、D四瓶溶液,它们是硫酸钠,亚硫酸钠、盐酸和氯化钡溶液.为了鉴别它们,各取少量溶液进行两两反应,结果如表所示,表中“↓”表示有沉淀或微溶物质生成,“↑”表示有气体生成,“-”表示无明显现象.由此可以推断它们的组成为:AHCl;BBaCl2;CNa2SO4;DNa2SO3.
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
8.能说明NH3分子的空间构型是三角锥形而不是平面正三角形的充分理由是( )
| A. | NH3与H+反应生成的NH4为正四面体结构 | |
| B. | NH3分子内3个共价键的键角、键长相等 | |
| C. | NH3分子内3个共价键的键长相等,3个键角都等于107° | |
| D. | NH3分子内3个共价键的键长相等,3个键角都等于120° |
12. 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
测得未知稀盐酸的物质的量浓度为0.096mol/L(保留小数点后3位).
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
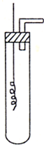 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.