题目内容
14.常温下,对于0.1mol•L-1的氨水,下列说法正确的是( )| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
分析 A.加水稀释氢氧根离子浓度减小,结合Kw分析;
B.加碱抑制氨水的电离;
C.根据同离子效应分析;
D.电离平衡常数只有温度有关.
解答 解:A.加水稀释氢氧根离子浓度减小,由于Kw=c(H+)×c(OH-)不变,所以c(H+)增大,故A错误;
B.加入少量NaOH固体,溶液中氢氧根离子浓度增大,抑制氨水的电离,则电离度减小,故B错误;
C.加入少量NH4Cl固体,铵根离子浓度增大,氨水电离平衡向左移动,故C错误;
D.电离平衡常数只有温度有关,所以通入少量HCl气体后,电离平衡常数不变,故D正确.
故选D.
点评 本题考查了弱电解质的电离,根据弱电解质电离特点及影响电离平衡的因素解答,题目难度不大,易错选项是A,注意稀释氨水时氢离子浓度增大,为易错点.

练习册系列答案
相关题目
4.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
2.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量[Al(OH)4]-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
9.下列说法正确的是( )
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 | |
| D. | 研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
3.下列说法正确的( )
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
3.某研究性学习小组为研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4-K2SO4+CO2↑+H2O.
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.
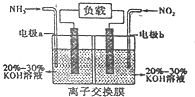
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.

①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.