题目内容
15.下列装置或操作不能达到实验目的是( )| 目的 | A.实验室制取并收集O2 | B.检验装置气密性 | C.制取蒸馏水 | D.分离水和四氯化碳 |
| 装置或操作 | 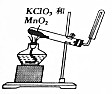 | 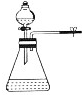 | 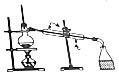 | 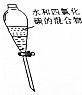 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.实验室用氯酸钾和二氧化锰混合加热制取氧气,氧气密度大于空气,要采用向上排空气法收集;
B.能形成压强差的装置可以检验装置气密性;
C.制取蒸馏水时,温度计测量馏分温度,且冷凝管中水遵循“下口进上口出”原则;
D.互不相溶的液体采用分液方法分离.
解答 解:A.实验室用氯酸钾和二氧化锰混合加热制取氧气,氧气密度大于空气,要采用向上排空气法收集,所以收集气体的试管应该口向上,故A错误;
B.能形成压强差的装置可以检验装置气密性,如果关闭止水夹,打开分液漏斗中活塞和瓶塞,如果分液漏斗中液面下降,则气密性不好,否则气密性良好,故B正确;
C.制取蒸馏水时,温度计测量馏分温度,且冷凝管中水遵循“下口进上口出”原则,符合实验操作,故C正确;
D.互不相溶的液体采用分液方法分离,水和四氯化碳不互溶,所以可以采用分液方法分离,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及气体的制取和收集、气密性检验、物质制备、物质分离提纯,明确实验原理及实验基本操作方法是解本题关键,注意从实验操作规范性及物质性质分析评价,易错选项是A.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
3.下列说法正确的( )
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
10.某学生做完实验后,采用下列方法清洗所用仪器:
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
①用稀硝酸清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断.正确的是( )
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
20.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
7.在由水电离产生的H+的浓度为1×10-13 mol•L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2-
②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-.
①K+、Cl-、NO3-、S2-
②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-.
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
3.某研究性学习小组为研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4-K2SO4+CO2↑+H2O.
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.
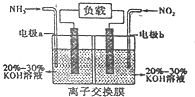
①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
(4)利用反应6NO2+8NH3═7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示.

①电极a为负极,其电极反应式为2NH3-6e-+60H-=N2+6H2O.
②当有2.24L NO2(标准状况下)被处理时,转移电子为0.4mol.
③为使电池持续放电,该离子交换膜需选用阴离子交换膜.
4.下表列出了2种燃煤烟气脱硫方法的原理:
(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O═(NH4)2SO3;4NH3+2SO2+2H2O+O2═2(NH4)2SO4.下列说法正确的是AC(填字母).
A.两个都是化合反应
B.两个都是氧化还原反应
C.可以用HCl鉴别(NH4)2SO3、(NH4)2SO4溶液
D.可以用Ba(OH)2鉴别(NH4)2SO3、(NH4)2SO4两种溶液
(2)方法Ⅱ中发生的化学反应方程式为SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4.
(3)①某地化石燃料煤的使用量很大,收集该地区的雨水,经测pH5.6,放置一个星期后,再测pH应小于5.6(填“大于”、“小于”或“等于”),原因是2H2SO3+O2=2H2SO4(用化学方程式表示).
②为了变废为宝,该地将SO2炉气精制获得精制炉气,将精制炉气(含SO2、O2、N2)催化氧化以便制取硫酸.在实际生产中,此反应可选择的反应条件:A.常压、450℃左右,SO2转化率为95% B.10个大气压、450℃左右,SO2转化率为97.5%应选择A(填“A”或“B”).
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
A.两个都是化合反应
B.两个都是氧化还原反应
C.可以用HCl鉴别(NH4)2SO3、(NH4)2SO4溶液
D.可以用Ba(OH)2鉴别(NH4)2SO3、(NH4)2SO4两种溶液
(2)方法Ⅱ中发生的化学反应方程式为SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4.
(3)①某地化石燃料煤的使用量很大,收集该地区的雨水,经测pH5.6,放置一个星期后,再测pH应小于5.6(填“大于”、“小于”或“等于”),原因是2H2SO3+O2=2H2SO4(用化学方程式表示).
②为了变废为宝,该地将SO2炉气精制获得精制炉气,将精制炉气(含SO2、O2、N2)催化氧化以便制取硫酸.在实际生产中,此反应可选择的反应条件:A.常压、450℃左右,SO2转化率为95% B.10个大气压、450℃左右,SO2转化率为97.5%应选择A(填“A”或“B”).