题目内容
13.25℃时,pH=13的氨水溶液,下列说法不正确的是( )| A. | 溶液中C(OH-)=0.1mol•L-1 | B. | 溶液中C(OH-)>C(H+) | ||
| C. | 该氨水的浓度为0.1mol•L-1 | D. | 溶液中水的离子积为1×10-14 |
分析 25℃时,pH=13的氨水溶液显碱性,据此可知c(H+)和c(OH-)的相对大小;溶液中c(H+)=10-13mol/L,c(OH-)=10-1mol/L,由于一水合氨是弱碱,不能完全电离,据此分析氨水的浓度;水的离子积只与温度有关,与溶液的环境无关,据此分析.
解答 解:A、25℃时,pH=13的氨水溶液中c(H+)=10-13mol/L,c(OH-)=10-1mol/L=0.1mol/L,故A正确;
B、氨水溶液显碱性,据此可知c(H+)<c(OH-),故B正确;
C、25℃时,pH=13的氨水溶液中c(OH-)=0.1mol/L,由于一水合氨为弱电解质,不能完全电离,故弱若使c(OH-)=0.1mol/L,则氨水的浓度必须远大于0.1mol/L,故C错误;
D、水的离子积只与温度有关,与溶液的环境无关,无论在什么温度下,只要是在25℃时,水的离子积均为10-14,故D正确.
故选C.
点评 本题考查了弱电解质的电离以及溶液中的离子浓度的有关计算,难度不大,应注意的是弱电解质不能完全电离.

练习册系列答案
相关题目
4.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
8.下列对化学用语的理解正确的是( )
| A. | 结构示意图 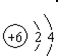 :表示碳原子 :表示碳原子 | |
| B. | 比例模型 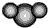 :表示二氧化碳分子 :表示二氧化碳分子 | |
| C. | 电子式 :表示羟基 :表示羟基 | |
| D. | H++OH-═H2O:表示醋酸和氢氧化钠的反应 |
18.下列关于有机物的说法不正确的是( )
| A. | 乙烯能使溴的CCl4溶液褪色是因为发生了加成反应反应 | |
| B. | 苯不能使溴的CCl4溶液褪色,说明苯分子中不存在碳碳双键 | |
| C. | 要除去乙酸乙酯中的少量乙酸可以加入少量乙醇和浓硫酸再加热 | |
| D. | 葡萄糖能与新制的氢氧化铜反应,说明葡萄糖是还原性糖 |
2.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量[Al(OH)4]-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
3.下列说法正确的( )
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |

 .
.