题目内容
11.钛(Ti)由于稳定的化学性质,良好的耐高温、耐低温、抗腐蚀性以及强度、低密度被誉为“太空金属”.工业上制金属钛是先将金红石(TiO2)和碳粉混合加热至1000~1100K进行氯化处理,发生反应如下:TiO2(s)+2C(s)+2Cl2(g)?TiCl4(g)+2CO(g)+72.1kJ,在采用金属热还原法还原四氯化钛(TiCl4)得到钛.完成下列填空:
氯化反应的平衡常数表达式K=$\frac{{c}^{2}(CO)}{{c}^{2}(C{l}_{2})}$.若反应容器的容积为2L,4min后达到平衡,测得固体的质量减少了10.4g,则Cl2平均反应速度为0.025mol/(L•min)
分析 平衡常数指一定温度下到达平衡时,生成物浓度化学计量数次数幂之积与反应物浓度化学计量数次数幂之积的比值;
根据差量法计算参加反应的Cl2的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(HCl).
解答 解:可逆反应TiO2(s)+2C(s)+2Cl2(g)?TiCl4(g)+2CO(g)的平衡常数k=$\frac{{c}^{2}(CO)}{{c}^{2}(C{l}_{2})}$;
反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
TiO2(s)+2C(s)+2Cl2(g)?TiCl4(g)+2CO(g) 固体的质量减少
80 24 2mol 104
n(Cl2) 10.4g
故n(Cl2)=0.2mol,
则v(Cl2)=$\frac{\frac{0.2mol}{2L}}{4min}$=0.025mol/(L•min),
故答案为:$\frac{{c}^{2}(CO)}{{c}^{2}(C{l}_{2})}$;0.025.
点评 本题考查化学平衡常数、反应速率计算,比较基础,注意利用差量法计算参加反应的氯气的物质的量.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
2.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量[Al(OH)4]-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
16.用惰性电解电解饱和食盐水时,阴极发生的离子反应方程式为( )
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
3.下列说法正确的( )
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
20.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
20.将0.8mol I2(g)和1.2mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)=2HI(g)并达到平衡.HI的体积分数随时间的变化如表格所示:
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程.
(2)在条件I从开始反应到到达平衡时,H2的反应速率为0.12 mol/(L•min).
(3)为达到条件II的数据,对于反应体系可能改变的操作是降低温度.
(4)该反应的△H<0(填“>“,“<“或“=“)
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半.请在图中画出c(HI)随时间变化的曲线.
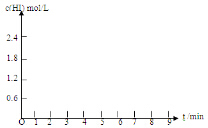
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
(2)在条件I从开始反应到到达平衡时,H2的反应速率为0.12 mol/(L•min).
(3)为达到条件II的数据,对于反应体系可能改变的操作是降低温度.
(4)该反应的△H<0(填“>“,“<“或“=“)
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半.请在图中画出c(HI)随时间变化的曲线.
