题目内容
7.某温度(t℃)时,水的Kw=1×10-12,该温度>25℃(填“>”“<”或“=”),其理由是水的电离是吸热的,升高温度,水的电离平衡右移,水的离子积常数增大.该温度下,c(H+)=1×10-7mol•L-1的溶液呈碱(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=10-7mol•L-1.分析 室温下,纯水中C(H+)=C(OH-)=$\sqrt{Kw}$,根据pH=7与纯水的pH比较确定溶液的酸碱性,如果纯水的pH大于7,则该溶液呈酸性,如果等于7,则呈中性,如果小于7,则呈碱性,水的电离是吸热的,升高温度,水的电离平衡右移,水的离子积常数增大.
解答 解:水的电离是吸热的,升高温度,水的电离平衡右移,水的离子积常数增大,若水的Kw=1×10-12>1×10-14,则温度高于25℃,该温度下,c(H+)=1×10-7mol•L-1的溶液,c(OH-)=1×10-5mol•L-1,氢氧根离子浓度大于氢离子浓度,显示碱性,该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=H2O电离出来的c(H+)=10-7mol•L-1.
故答案为:>;水的电离是吸热的,升高温度,水的电离平衡右移,水的离子积常数增大;碱;10-7.
点评 本题考查了溶液酸碱性的判断以及水的电离平衡的影响因素知识,注意溶液的酸碱性不能根据溶液的pH判断,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.将78g金属钾在空气中燃烧,生成KO2和K2O2的混合物.该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为( )
| A. | 0.50 mol | B. | 0.75 mol | C. | 1.00 mol | D. | 1.50 mol |
15.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是( )
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
2.如表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是( )
| 元素符号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与L形成的最高价氧化物对应水化物的碱性:L>M | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与等浓度的稀盐酸反应的速率为Q>L |
12.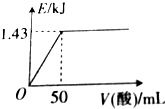 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |




 实验室常用如图所示的简易装置进行NO气体的制备和收集
实验室常用如图所示的简易装置进行NO气体的制备和收集