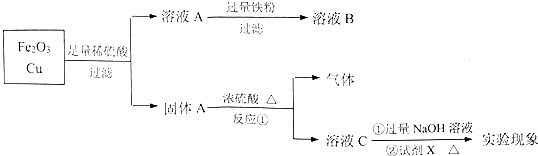
题目内容
20.将0.5mol下列物质分别加入100mL 5mol/L NaOH溶液中,完全反应后,所得溶液中阴离子浓度的大小顺序是( )①Al ②Al2O3 ③Al(OH)3 ④AlCl3.
| A. | ①>②>③>④ | B. | ④>①>②>③ | C. | ②>①=③>④ | D. | ①>②=③>④ |
分析 氢氧化钠分别下列各物质的反应方程式为:①2Al+2NaOH+2H2O=2NaAlO2+3H2↑;②Al2O3+2NaOH=2NaAlO2+H2O; ③Al(OH)3+NaOH=NaAlO2+2H2O; ④AlCl3+3NaOH=Al(OH)3+3NaCl,由此分析解答.
解答 解:氢氧化钠分别下列各物质的反应方程式为:①2Al+2NaOH+2H2O=2NaAlO2+3H2↑,0.5mol的铝与0.5mol的氢氧化钠恰好完全反应生成0.5mol的偏铝酸根离子,而反应中消耗溶剂水,所以溶剂的体积减少,浓度变大;
②Al2O3+2NaOH=2NaAlO2+H2O
1mol 2mol
0.5mol 0.5mol
所以氧化铝过量,生成0.5mol的偏铝酸根离子,同量产生0.25mol的水,而反应中生成溶剂水,体积增大,所以浓度变小;
③Al(OH)3+NaOH=NaAlO2+2H2O,两者恰好完全反应,生成0.5mol的偏铝酸根离子,同时产生1mol的水,所以阴离子的浓度比②小;
④AlCl3+3NaOH=Al(OH)3+3NaCl,
1mol 3mol
0.5mol 0.5mol,所以氯化铝过量,最终得氯化钠和氯化铝的混合溶液,所以阴离子的物质的量为1.5mol,所以所得溶液中阴离子浓度的大小顺序是④>①>②>③,故选B.
点评 本题考查根据方程式的计算,比较基础,清楚反应过程溶剂的量变化和过量问题的判断是解题的关键.

练习册系列答案
相关题目
10.在强酸性的无色溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
11.同一周期的X、Y、Z三种元素,已知最高价氧化物水化物酸性强弱是:HXO4>H2YO4>H3ZO4,则下列判断不正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物稳定性按X、Y、Z依次减弱 | |
| C. | 非金属性:X>Y>Z | |
| D. | 阴离子还原性:X-<Y2-<Z3- |
15.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是( )
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
12.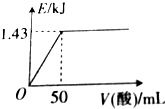 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
9.下列不能根据元素电负性判断元素( )
| A. | 是金属还是非金属 | B. | 正负化合价 | ||
| C. | 化学键类型 | D. | 化合物溶解度 |

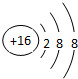 ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;E的单质中,质软有润滑性的是石墨(填写单质名称).