题目内容
4. 如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编 号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | Cl2 | HCl | O2 |
| A. | ②③④① | B. | ③①④② | C. | ③②①④ | D. | ④③②① |
分析 相同温度下,一定体积的容器中气体压强与气体的物质的量成之比,气体的物质的量越大其压强越大,结合发生的反应来解答.
解答 解:设A、B中的体积均为V,
①中硫化氢与二氧化硫反生成硫单质和水,2H2S+SO2=3S↓+2H2O,反应后气体体积减小,剩余SO2气体体积0.5V;
②中氢气和氯气在常温下不反应,气压不变,剩余气体为2V;
③中氨气和氯化氢反应生成氯化铵,反应后气体压强为零,剩余气体为0;
④中一氧化氮和氧气化合会生成二氧化氮,即2NO+O2═2NO2,然后发生2NO2?N2O4,反应后气体体积减小,剩余O2气体体积为积0.5V,生成NO2体积V,剩余气体总体积约1.5V;
则使两烧瓶内气体充分接触后,容器内压强由小到大的顺序为③①④②,
故选B.
点评 本题考查阿伏伽德罗定律,为高频考点,把握物质的性质、发生的反应及气体的压强为解答的关键,侧重分析与应用能力的考查,注意阿伏伽德罗定律及推论的应用,题目难度不大.

练习册系列答案
相关题目
15.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是( )
| A. | 溶液I中含有溶质的组合可能有4种 | |
| B. | 已知V和a的具体数值可以确定溶液I的溶质 | |
| C. | 已知溶液I中溶质的种类和a值,一定能求出V | |
| D. | 向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质 |
12.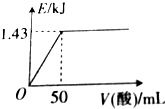 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
 向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )
向50mL0.5mol•L-1NaOH溶液中加入某种浓度的稀硫酸,测得加入稀硫酸的体积与反应放出的热量关系如图所示(不考虑热量损失),该稀硫酸中硫酸的物质的量浓度为( )| A. | 0.5mol•L-1 | B. | 0.4mol•L-1 | C. | 0.25mol•L-1 | D. | 0.1mol•L-1 |
9.下列不能根据元素电负性判断元素( )
| A. | 是金属还是非金属 | B. | 正负化合价 | ||
| C. | 化学键类型 | D. | 化合物溶解度 |
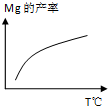 除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g)
除电解法,工业炼镁还可采用硅热法(Pidgeon法).即以煅白(CaO•MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:2(CaO•MgO)(s)+Si(s)?Ca2SiO4 (l)+2Mg(g) 实验室常用如图所示的简易装置进行NO气体的制备和收集
实验室常用如图所示的简易装置进行NO气体的制备和收集
 (其中一种)(写结构简式,一种即可).
(其中一种)(写结构简式,一种即可). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl
+NaCl +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.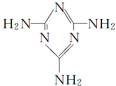 )俗称“蛋白精”,三聚氰酸(
)俗称“蛋白精”,三聚氰酸( 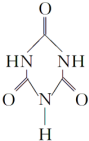 ).
).