题目内容
3.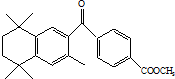 蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )| A. | 蓓萨罗丁的分子式为C24H28O3 | |
| B. | 蓓萨罗丁分子中一定有17个碳原子在同一平面内 | |
| C. | 蓓萨罗丁可以与氢气发生加成反应,1mol蓓萨罗丁最多消耗8 mol H2 | |
| D. | 蓓萨罗丁能与NaOH溶液反应,但是不能使酸性KMnO4溶液褪色 |
分析 A.根据结构简式确定分子式;
B.苯环上所有原子共平面,HCHO分子中所有原子共平面,据此判断共平面碳原子个数;
C.苯环和羰基能和氢气发生加成反应;
D.连接苯环的碳原子上含有H原子的有机物能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.根据结构简式确定分子式为C24H28O3,故A正确;
B.苯环上所有原子共平面,HCHO分子中所有原子共平面,据此判断共平面碳原子个数最多为18,故B错误;
C.苯环和羰基能和氢气发生加成反应,则1mol蓓萨罗丁最多消耗7 mol H2,故C错误;
D.连接苯环的碳原子上含有H原子的有机物能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以该物质中连接苯环的甲基能被酸性高锰酸钾溶液氧化生成-COOH而使酸性高锰酸钾溶液褪色,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识迁移能力,明确官能团及其性质关系是解本题关键,注意酯基不能和氢气发生加成反应,易错选项是BC.

练习册系列答案
相关题目
11.下列化学用语表述正确的是( )
| A. | 羟基的电子式: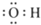 | B. | 醛基的结构简式-COH | ||
| C. | 乙烯分子的最简式:CH2 | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
18.下列溶液中,微粒的浓度关系正确的是( )
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
8.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 铍的氧化物对应的水化物具有两性 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,钠的燃烧产物比铷(Rb)的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 60gSiO2晶体有σ键4NA | |
| B. | 在标准状况下,2.24 LSO3中含有的氧原子数为0.3NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 标准状况下,2.24LCl2通入足量H2O溶液中转移的电子数为0.1NA |
13.过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸.某实验小组拟探究CaO2的性质及其实验室制法.
(1)实验探究CaO2与酸的反应.
①CaO2与盐酸反应的化学方程式为2CaO2+4HCl═2CaCl2+2H2O+O2↑.
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2.
(2)用如图1所示装置制备过氧化钙,其反应原理为Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CaO2
①请选择实验所需的装置,按气流方向连接的顺序为d→e→f→b→c→c(或d→e→f→c→b→c)(填仪器接口的字母,上述装置可不选用也可重复使用).
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作);Ⅳ拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图2所示.
①NH3在Ca2+和 H2O2的反应过程中所起的作用是中和生成的氢离子,促进反应进行.
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2•8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次.
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.
(1)实验探究CaO2与酸的反应.
操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2.
(2)用如图1所示装置制备过氧化钙,其反应原理为Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CaO2

①请选择实验所需的装置,按气流方向连接的顺序为d→e→f→b→c→c(或d→e→f→c→b→c)(填仪器接口的字母,上述装置可不选用也可重复使用).
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作);Ⅳ拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图2所示.
①NH3在Ca2+和 H2O2的反应过程中所起的作用是中和生成的氢离子,促进反应进行.
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2•8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次.
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.

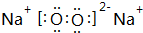 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程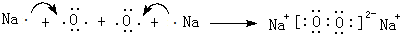 .
.