题目内容
18.下列溶液中,微粒的浓度关系正确的是( )| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.硝酸钠是强酸强碱盐,硝酸根离子和钠离子都不水解,根据物料守恒判断;
D.亚铁离子抑制NH4+水解,碳酸根离子促进NH4+水解,NH4+水解程度越大,相同c(NH4+)的这三种盐其浓度越大.
解答 解:A.任何电解质溶液中都存在电荷守恒,如果溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO-),故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=c(F-)+c(HF),故B错误;
C.硝酸钠是强酸强碱盐,硝酸根离子和钠离子都不水解,根据物料守恒得c(Na+)=c(NO3-),故C正确;
D.亚铁离子抑制NH4+水解,碳酸根离子促进NH4+水解,NH4+水解程度越大,相同c(NH4+)的这三种盐其浓度越大,所以其浓度大小顺序是(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2,故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质是解本题关键,注意结合溶液中存在的守恒分析解答,易错选项是C,溶液中存在的物料守恒与溶液酸碱性无关,题目难度不大.

练习册系列答案
相关题目
10.10.0mL 某气态烃在 50.0mL O2中充分燃烧,得到液态水和35.0mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol OD-离子含有的质子、中子数均为10NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
6.下列离子方程式正确的是( )
| A. | 向碳酸氢钠溶液中滴入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| C. | 在KHSO4溶液中加入少量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
13.常温下单质硫主要以S8(皇冠形结构)形式存在.加热时,S8会转化为S6、S4、S2等,当温度达到750℃时,硫蒸气主要以S2形式存在(占92%).下列说法中正确的是( )
| A. | S8转化为S6、S4、S2属于物理变化 | |
| B. | 不论哪种硫分子,完全燃烧时都生成SO3 | |
| C. | S8分子中硫原子的杂化方式是sp3杂化 | |
| D. | 把硫单质在空气中加热到750℃即得S2 |
3.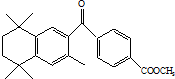 蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )
 蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,其结构简式如图,下列关于蓓萨罗丁判断正确的是( )| A. | 蓓萨罗丁的分子式为C24H28O3 | |
| B. | 蓓萨罗丁分子中一定有17个碳原子在同一平面内 | |
| C. | 蓓萨罗丁可以与氢气发生加成反应,1mol蓓萨罗丁最多消耗8 mol H2 | |
| D. | 蓓萨罗丁能与NaOH溶液反应,但是不能使酸性KMnO4溶液褪色 |
10.下列反应中,属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2=2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | C2H6+Cl2$\stackrel{光}{→}$C2H5Cl+HCl |
8.“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分与漂白液中的有效成分相同,这种物质是( )
| A. | KMnO4 | B. | NaClO | C. | Ca(ClO)2 | D. | HNO3 |
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.