题目内容
13.用KMnO4氧化一定体积密度为1.19g/cm3,溶质质量分数为36.5%的 盐酸.反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(1)用双线桥法分析该反应(只需标出电子得失的方向和数目)
(2)15.8g KMnO4参加反应能消耗多少摩尔HCl?
(3)产生的Cl2在标准状况下的体积为多少升?
分析 (1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(2)根据方程式计算需要HCl的物质的量;
(3)据方程式计算生成氯气的物质的量,再根据V=22.4n计算生成氯气的体积.
解答 解:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,则转移电子数为10e-,所以双线桥法可表示为: ;
;
故答案为: ;
;
(2)设参加反应的HCl的物质的量为n,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 16
15.8g n
n=$\frac{16×15.8}{2×158}$=0.8mol
答:15.8g KMnO4参加反应能消耗0.8molHCl;
(3)设生成氯气的物质的量为a,则:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158 5
15.8g a
所以a=$\frac{15.8×5}{2×158}$=0.25mol,
故生成标况下氯气的体积为0.25mol×22.4L/mol=5.6L,
答:标况下生成氯气的体积为5.6L.
点评 本题考查化学方程式有关计算,难度不大,侧重考查学生简单计算能力,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列物质在水溶液中的电离方程式书写错误的是( )
| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
1.下列反应条件的控制中不恰当的是( )
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
1.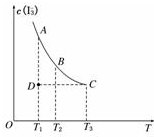 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )| A. | 该反应的正反应是吸热反应 | B. | A点与C点的化学反应速率vA<vC | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | A点与B点相比,B点的c(I2)大 |
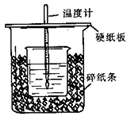 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: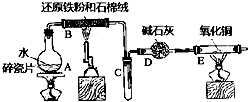 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去) 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.