题目内容
8.按要求填空:(1)0.4mol OH-的质量为6.8g,其中含有2.408×1024个电子.
(2)质量比为16:7:6的三种气体S02、CO、NO,氧原子个数之比为10:5:4;同条件下体积比为5:5:4.
(3)标准状况下,1体积水能溶解448体积HCI,所得溶液的密度为1.1g/mL,该溶液的质量分数和物质的量的浓度分别是42.2%、12.7mol•L-1.(保留1位小数)
分析 (1)OH-的摩尔质量为17g/mol,根据m=nM计算其质量,OH-含有10个电子,电子物质的量为氢氧根离子的10倍,再根据N=nNA计算电子数目;
(2)根据n=$\frac{m}{M}$计算 SO2、CO、NO的物质的量之比,结合分子式计算含有氧原子数目之比,相同条件下气体体积之比等于其物质的量之比;
(3)设水的体积为1L,则HCl的体积为448L,根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,根据m=nM计算HCl质量,溶液质量=水的质量+HCl的质量,质量分数=$\frac{HCl质量}{溶液质量}$×100%,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)OH-的摩尔质量为17g/mol,0.4mol OH-的质量为 0.4mol×17g/mol=6.8g,OH-含有10个电子,则0.4mol OH-含有电子数目为0.4mol×10×6.02×1023mol-1=2.408×1024,
故答案为:6.8g; 2.408×1024;
(2)质量比为16:7:6的SO2、CO、NO的物质的量之比为$\frac{16g}{64g/mol}$:$\frac{7g}{28g/mol}$:$\frac{6g}{30g/mol}$=5:5:4,则含有氧原子数目之比为5×2:5×1:4×1=10:5:4,相同条件下气体体积之比等于其物质的量之比,三者体积比为5:5:4,
故答案为:10:5:4;5:5:4;
(3)设水的体积为1L,则HCl的体积为448L,标况下HCl物质的量=$\frac{448L}{22.4L/mol}$=20molHCl质量为20mol×36.5g/mol=730g,溶液质量=1L×1000g/L+730g=1730g,
溶液质量分数=$\frac{730g}{1730g}$×100%=42.2%,
溶液体积=$\frac{1730g}{1100g/L}$=$\frac{173}{110}$L,则物质的量浓度为$\frac{20mol}{\frac{173}{110}L}$=12.7mol•L-1.
故答案为:42.2%;12.7mol•L-1.
点评 本题考查了物质的量的有关计算,熟悉基本公式并灵活运用公式来分析解答,知道公式中各个物理量之间的关系,题目难度不大.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是人体必需的营养素 | |
| C. | 葡萄糖是一种多羟基醛,不具有还原性 | |
| D. | 糖类是具有Cn(H2O)m通式的物质,糖也称为碳水化合物 |
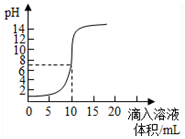
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
| A. | 在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA | |
| B. | 该反应配平后H+的化学计量数为6 | |
| C. | 该反应右边横线上的产物为OH- | |
| D. | 该反应的氧化剂为H2C2O4 |
已知:

| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
(1)如图1为课本上制取乙酸乙酯的实验装置图,请回答下列问题:

①浓硫酸的作用是催化剂、吸水剂;
②实验开始前在饱和碳酸钠加入酚酞,溶液会变红,随着乙酸乙酯的蒸出,红色会变浅,但是无气体产生,请写出发生该变化的离子反应方程式CH3COOH+CO32-=CH3COO-+HCO3-;
(2)按照图2所示装置制备苯甲酸乙酯.
①制备:在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,其中分水器的作用是分离出反应生成的水,控制温度加热回流2h.
a.实验中使用分水器不断分离除去水的目的是分离反应过程中生的水,促进酯化反应向正反应方向进行;
b.从提供的分析实验室制取苯甲酸乙酯为什么不使用制取乙酸乙酯一样的装置?如果使用制取乙酸乙酯的装置,会使乙醇大量蒸馏出去,实验效率大大降低
②产品的提纯
将圆底烧瓶中的残液倒入盛有冷水的烧瓶中,分批加入Na2CO3溶液呈中性;用分液漏斗分出有机层得粗产品.水层用25mL乙醚萃取分液,醚层与粗产品合并;在粗产品加入无水氯化钙后,静置、过滤,过滤液进行蒸馏,蒸出乙醚后,继续升温,接收210~213℃的馏分;产品经检验合格,测得产品体积为6mL.
c.在该实验分液过程中,产物应该从分液漏斗的上口倒出 (填“上口倒出”可“下口倒出”);
d.该实验中苯甲酸乙酯的产率为42%;
e.若加入的Na2CO3溶液不足,在之后的蒸馏时烧瓶内会出现白烟生成,产生该现象的原因在苯甲酸乙酯中有未除尽的苯甲酸,受热至100℃时升华.
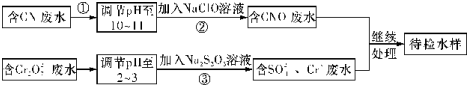
 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目: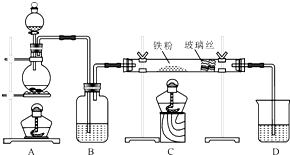 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.