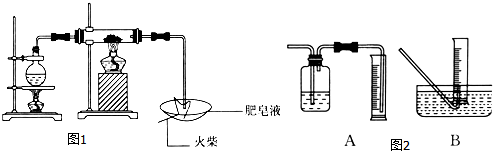
题目内容
3.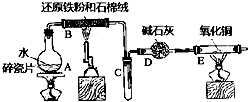 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)回答下列问题:
(1)装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)E中出现黑色氧化铜变红,玻璃管右端出现无色液滴的现象.
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①Fe3+的价电子排布式是3d5
②欲检验溶液中含有Fe3+,选用的试剂为硫氰化钾(KSCN),现象是溶液变红.
③该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+,可能的原因:2Fe3++Fe=3Fe2+.
④在此溶液中加入少量酸性高锰酸钾溶液,高锰酸钾褪色,溶液中反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
⑤将此滤液中FeCl2完全氧化为FeCl3最好选择Cl2做氧化剂.
分析 (1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(2)氢气能够还原氧化铜生成铜和水,据此判断现象;
(3)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,原子形成阳离子失去高能层中该能级电子,再失去同能层中低能级电子,然后再失去低能层中电子;
②三价铁离子能够与硫氰酸根离子发生络合反应生成血红色的络合物;
③三价铁离子能够氧化铁粉生成二价铁离子;
④高锰酸钾具有强的氧化性,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为二价锰离子;
⑤氯气氧化氯化亚铁生成氯化铁.
解答 解:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)铁与水蒸气反应生成的氢气能够与氧化铜发生氧化还原反应生成铜和水,所以会看到现象:黑色氧化铜变红,玻璃管右端出现无色液滴;
故答案为:黑色氧化铜变红,玻璃管右端出现无色液滴;
黑色氧化铜变红,玻璃管右端出现无色液滴
(3)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,原子形成阳离子失去高能层中该能级电子,再失去同能层中低能级电子,然后再失去低能层中电子,故基态Fe3+的价电子排布式可表示为3d5,
故答案为:3d5;
②三价铁离子能够与硫氰酸根离子发生络合反应生成血红色的络合物,通常用硫氰化钾(KSCN)碱液三价铁离子,现象为溶液变红;
故答案为;硫氰化钾(KSCN); 溶液变红;
③三价铁离子能够氧化铁粉生成二价铁离子,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
④高锰酸钾具有强的氧化性,酸性环境下能够氧化二价铁离子生成三价铁离子,本身被还原为二价锰离子,离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
⑤氯气氧化氯化亚铁生成氯化铁,不会引人新的杂质;
故答案为:Cl2.
点评 本题以FeCl3•6H2O晶体制备为载体,考查了铁及其化合物的性质,明确相关物质的性质是解题关键,注意铁离子的检验方法,题目难度不大.

| A. | 在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA | |
| B. | 该反应配平后H+的化学计量数为6 | |
| C. | 该反应右边横线上的产物为OH- | |
| D. | 该反应的氧化剂为H2C2O4 |
| |温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的△H<0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003mol•L-1•s-1,则6s末CO2的物质的量浓度为0.018mol•L-1;反应经一段时间后,达到平衡后CO的转化率为80%;
(3)判断该反应是否达到平衡的依据为cd(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O):c(CO)应不低于14.4;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式O2+4e-+2CO2═2CO32-.

 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目:
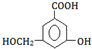
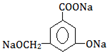 .
.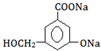 .
.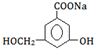 .
.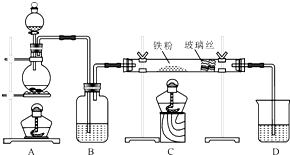 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.