题目内容
9.下列实验操作和实验问题的处理方法中正确的是( )| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
分析 A.碘和四氯化碳的混合物,互溶,但沸点不同;
B.分液时,避免上下层液体混合;
C.蒸发时利用余热加热;
D.水银有毒.
解答 解:A.碘和四氯化碳的混合物,互溶,但沸点不同,应选蒸馏法分离,故A错误;
B.分液时,避免上下层液体混合,则下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中,故B正确;
C.蒸发时利用余热加热,则出现大量固体时,停止加热,故C错误;
D.水银有毒,应撒硫粉处理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验操作、实验安全、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
20.已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.则该温度下,下列说法正确的是
( )
( )
| A. | 在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| B. | 饱和Mg(OH)2溶液与饱和MgF2 溶液相比,前者的c(Mg2+)大 | |
| C. | Mg(OH)2固体在0.01mol/L氨水中的Ksp比在 0.01mol/L NH4Cl 溶液中的Ksp小 | |
| D. | 在Mg(OH)2的悬浊液加入NaF 溶液后,不可能有MgF2沉淀生成 |
4.设NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 标况下,4.48L氦气和重氢气的混合物中含中子数为0.4NA | |
| B. | 在含有4molSi-O键的石英晶体中,氧原子数目为2 NA | |
| C. | 7.8克过氧化钠中,所含阴、阳离子总数为0.4NA | |
| D. | 28克N60单质中(如图),含的N-N键(σ键)个数为3 NA |
14.已知反应2N2O5(g)?4NO2(g)+O2(g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下:
请回答下列问题:
(1)该速率表达式中,m=1,k正=0.35min-1.
(2)若某时刻c(N2O5)=0.100mol•L-1,则v正≈0.035mol.L-1.min-1.
(3)第4min时,该可逆反应v正≥(填“>”“<”或“=”或“≥”)v逆.
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
(1)该速率表达式中,m=1,k正=0.35min-1.
(2)若某时刻c(N2O5)=0.100mol•L-1,则v正≈0.035mol.L-1.min-1.
(3)第4min时,该可逆反应v正≥(填“>”“<”或“=”或“≥”)v逆.
18.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g),现分别从两条途径建立平衡:Ⅰ.A、B的起始浓度均为2mol/LⅡ.C、D的起始浓度分别为2mol/L和6mol/L,下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 达平衡时,Ⅰ途径的反应速率v1等于Ⅱ途径的反应速率v2 | |
| D. | 达平衡时,Ⅰ途径混合气体的密度与Ⅱ途径混合气体的密度相等 |
19.下面有关离子晶体的叙述中(氯化钠晶胞如图),不正确的是( )
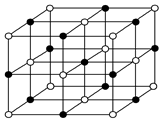

| A. | 1 mol氯化钠中有NA个NaCl分子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 平均每个NaCl晶胞中有4个Na+、4个Cl- |
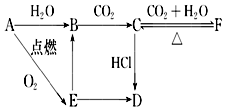 A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:
A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末: