题目内容
14.已知反应2N2O5(g)?4NO2(g)+O2(g)的分解速率表达式为v正=k正.cm(N2O5),k正是与温度有关的常数,340K时实验测得的有关数据如下:| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
(1)该速率表达式中,m=1,k正=0.35min-1.
(2)若某时刻c(N2O5)=0.100mol•L-1,则v正≈0.035mol.L-1.min-1.
(3)第4min时,该可逆反应v正≥(填“>”“<”或“=”或“≥”)v逆.
分析 (1)由表中数据可知,c(N2O5)浓度之比等于v正之比,则m=1,由任意一组数据根据v正=k正.c(N2O5)计算k正;
(2)根据v正=k正.c(N2O5)计算;
(3)对3min时对比,第4min时,浓度减小,但题目缺少4min之后的数据,不能确定是否达到平衡状态,以此解答.
解答 解:(1)温度不变,则k正相等,对比1、2min数据可知$\frac{0.08{0}^{m}}{0.13{3}^{m}}$=$\frac{0.028}{0.0466}$,m≈1,由2min数据可知,0.028mol.L-1.min-1=k正×0.080mol.L-1,解得k正≈0.35min-1,
故答案为:1;0.35min-1;
(2)340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.100mol•L-1×0.35min-1=0.035mol.L-1.min-1,故答案为:0.035mol.L-1.min-1;
(3)对3min时对比,第4min时,浓度减小,但题目缺少4min之后的数据,不能确定是否达到平衡状态,则此时v正≥v逆,
故答案为:≥.
点评 本题考查化学平衡的计算,为高频考点,侧重雨学生的分析能力和计算能力的考查,注意对数据的分析归纳,题目有利于培养学生良好的科学素养,难度中等.

练习册系列答案
相关题目
2.有关化合物的Ksp 如表所示(25℃时):
用废电池的锌皮制备ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2 溶解,铁变为Fe3+,加碱调节至pH 为3.7 时,Fe3+沉淀完全;继续加碱至pH 约为6时,锌开始沉淀(假定Zn2+的浓度为0.1mol•L-1).若上述过程不加H2O2,则Zn2+和Fe2+分离不开,其原因是Zn(OH)2、Fe(OH)2的Ksp相近.
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
9.下列实验操作和实验问题的处理方法中正确的是( )
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
19.下列关于溶液和胶体的叙述,正确的是( )
| A. | “血液透析”利用了胶体的性质 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 一束光线分别通过溶液和胶体时,前者会出现明显的光带,后者则没有 | |
| D. | 浓NaOH溶液中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
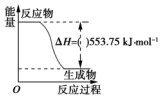 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题: