题目内容
1.探究温度对反应速率的影响的实验中Na2S2O3溶液与H2SO4溶液反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O;实验过程中其他条件相同,控制不同温度,记录出现沉淀的时间,从而证明温度越高,反应速率越快.分析 硫代硫酸钠溶液与稀硫酸反应生成硫、二氧化硫和硫酸钠,可观察到溶液变浑浊,温度越高,反应速率越大,开始出现浑浊的时间越少,以此解答该题.
解答 解:硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,温度越高,反应速率越大,开始出现浑浊的时间越少,可纪录出现沉淀的时间判断反应速率的大小.
故答案为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O;出现沉淀.
点评 本题考查探究影响反应速率因素,为高频考点,明确反应速率影响原理是解本题关键,注意把握物质的性质以及实验的原理和方法,难度不大.

练习册系列答案
相关题目
11.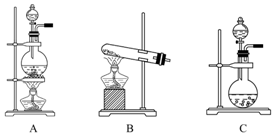 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:
(1)上述实验原理中,从反应中有无电子转移的角度看,明显不同于其他气体的是② (填编号),写出实验室常用的制取该气体的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2-→O2 | |
| ② | 制氨气 | NH4Cl-→NH3 | |
| ③ | 制氯气 | HCl-→Cl2 |
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其字母填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等)
(4)在浓CaCl2溶液中通入NH3和CO2可以制得碳酸钙,制取时应先通入的气体是NH3,该反应的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.
(5)制备8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为ACFGH
A.100mL量筒
B.托盘天平
C.玻璃棒
D.50mL容量瓶
E.10mL量筒
F.胶头滴管
G.100mL烧杯
H.100mL容量瓶
③下列实验操作中不正确的是BC (填写字母).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
9.下列实验操作和实验问题的处理方法中正确的是( )
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
10.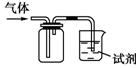 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )| 选项 | 试剂 | 现象 | 结论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
11.下列物质中能使酸性KMnO4溶液褪色,也能使溴水褪色的是( )
| A. | 2,3-二甲基-2-己烯 | B. | 苯 | ||
| C. | 已烷 | D. | 异丙苯 | ||
| E. | 环戊烷 |



