题目内容
下表是元素周期表的一部分.
用表中的①~⑨九种元素及其化合物,填写下列空白:
(1)②号元素的元素符号为 .
(2)非金属性最强的元素是 (填元素符号).
(3)常用来做半导体材料的元素是 (填元素符号).
(4)最高价氧化物的水化物中,碱性最强的是 (填化学式).
(5)最高价氧化物是两性氧化物的是 (填化学式).
(6)⑤、⑧两元素形成的化合物的电子式为 .
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ |
(1)②号元素的元素符号为
(2)非金属性最强的元素是
(3)常用来做半导体材料的元素是
(4)最高价氧化物的水化物中,碱性最强的是
(5)最高价氧化物是两性氧化物的是
(6)⑤、⑧两元素形成的化合物的电子式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为H,②为N,③为F,④为Ne,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,⑨为K,然后结合元素的单质、化合物的性质及化学用语来解答.
解答:
解:由元素在周期表中的位置可知,①为H,②为N,③为F,④为Ne,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,⑨为K,
(1)由上述分析可知,②为N,故答案为:N;
(2)上述元素中,非金属性最强的在元素周期表的右上角,为F元素,故答案为:F;
(3)上述元素中,常用来做半导体材料的元素是Si,故答案为:Si;
(4)上述元素中,金属性最强的为K,则最高价氧化物的水化物中,碱性最强的是KOH,故答案为:KOH;
(5)上述元素中,最高价氧化物是两性氧化物的是Al2O3,故答案为:Al2O3;
(6)⑤、⑧两元素形成的化合物为NaCl,属于离子化合物,其电子式为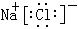 ,故答案为:
,故答案为: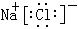 .
.
(1)由上述分析可知,②为N,故答案为:N;
(2)上述元素中,非金属性最强的在元素周期表的右上角,为F元素,故答案为:F;
(3)上述元素中,常用来做半导体材料的元素是Si,故答案为:Si;
(4)上述元素中,金属性最强的为K,则最高价氧化物的水化物中,碱性最强的是KOH,故答案为:KOH;
(5)上述元素中,最高价氧化物是两性氧化物的是Al2O3,故答案为:Al2O3;
(6)⑤、⑧两元素形成的化合物为NaCl,属于离子化合物,其电子式为
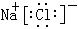 ,故答案为:
,故答案为: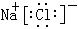 .
.
点评:本题考查元素周期律和元素周期表的综合应用,明确元素在周期表中的位置推出各元素是解答本题的关键,注意元素的单质、化合物的性质,题目难度不大.

练习册系列答案
相关题目
 某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )
某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )| A、该装置为原电池,通入O2的电极是负极 |
| B、该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O-2e-=2H++SO42- |
| C、该装置中,H+通过质子膜向左侧移动 |
| D、在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下22.4L SO2所含的分子数为NA |
| B、标准状况下22.4L CCl4所含的原子数为5NA |
| C、1L 1mol/L CaCl2溶液中所含的Cl-离子数为2NA |
| D、56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
在MgCl2和AlCl3的混合溶液中,Cl-的物质的量为0.7mol.向该溶液中逐渐加入100mL 8mol/L的KOH溶液,使之充分反应.反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x.(不考虑Mg2+和Al3+水解及水电离对离子数目的影响),以下叙述正确的是( )
| A、x的取值范围是0<x≤0.25 | ||
| B、无论x为何值,当加入87.5 mL的KOH时,溶液中的阳离子恰好完全沉淀 | ||
| C、当100 mL KOH刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为0.2 | ||
D、若反应前Al3+的物质的量为a mol,则a=
|

 【化学--物质结构与性质】
【化学--物质结构与性质】