题目内容
5.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4•6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表.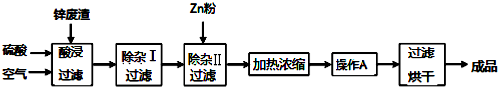
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+.为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.为控制上述pH范围可选择加入的试剂或药品是AD.
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于6.
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Fe3+(填离子符号)先沉淀,Ksp[Fe(OH)2]>Ksp[Cu(OH)2](填“>”、“=”或“<”)
分析 冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),加入硫酸通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+、Cu2+、Al3+,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,加热蒸发,浓缩结晶,过滤洗涤得到ZnSO4•6H2O晶体;
(1)依据过滤操操作需要的玻璃仪器;
(2)过氧化氢是绿色氧化剂氧化亚铁离子为铁离子,通过调节溶液PH除去铁离子、铝离子而氢氧化锌不沉淀,结合图表数据判断需要的PH和试剂,注意加入物质能调节溶液PH,不能引入新的杂质;
(3)依据沉淀的溶度积计算;
(4)根据表中的数据可知,开始沉淀的pH,加入氢氧化钠溶液时,pH值小的先沉淀.
解答 解:冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),加入硫酸通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+、Cu2+、Al3+,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,加热蒸发,浓缩结晶,过滤洗涤得到ZnSO4•6H2O晶体;
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+,便于完全沉淀;依据图表数据分析,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4;为控制上述PH范围可选择加入的试剂或药品不能引入新的杂质,氨水会引入铵根离子,固体氢氧化钠会引入钠离子,ZnO、ZnCO3,会降低溶液PH且不引入新的杂质;
故答案为:将Fe2+完全氧化为Fe3+;5.2~5.4;AD;
(3)常温下,已知Ksp〔Zn(OH)2〕=5×10-17,某ZnSO4溶液里c(Zn2+)=0.5mol•L-1,如果要生成Zn(OH)2沉淀,Q≥Ksp,Ksp〔Zn(OH)2〕=c(Zn2+)×c2(OH-)=5×10-17,c(OH-)=$\sqrt{\frac{Ksp}{c(Zn{\;}^{2+})}}$=$\sqrt{\frac{5×10{\;}^{-17}}{0.5}}$=10-8mol/L,c(H+)=10-6mol/L,PH=6,则应调整溶液pH大于6;
故答案为:6;
(4)根据表中的数据可知,开始沉淀的 pH,加入氢氧化钠溶液时,pH值小的先沉淀,所以Fe3+先沉淀,开始沉淀的 pH值,Fe(OH)2的大于Cu(OH)2的,所以Ksp[Fe(OH)2]>Ksp[Cu(OH)2],
故答案为:Fe3+;>.
点评 本题考查了物质分离实验过程和分离原理的理解应用,除杂试剂选择和提纯物质方法,沉淀溶解平衡的计算应用,掌握基础是关键,题目难度中等.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 原电池是把电能转变为化学能的装置 | |
| B. | 原电池中电子流出的一极是负极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,原电池中的阳离子向负极方向移动 |
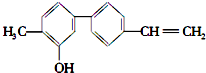
| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
| A. | 醋酸溶液加水稀释醋酸的电离程度增大 | |
| B. | 工业合成氨时常用通过过量的氮气的方法提高氢气的转化率 | |
| C. | 新制的氯水在光照的条件下颜色变浅 | |
| D. | 氯化铁溶液中加Fe粉振荡后颜色变浅 |
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
| A. | 钠的熔点较低 | B. | 钠的密度较小 | ||
| C. | 钠的失电子能力较强 | D. | 钠的导电性 |
