题目内容
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
分析 A、常温常压下气体摩尔体积大于22.4L/mol;
B、求出氯气的物质的量,然后根据1mol氯气与氢氧化钠转移1mol电子来分析;
C、NO2和N2O4的最简式均为NO2;
D、氨水中存在平衡:NH3+H2O?NH3•H2O;
解答 解:A、常温常压下气体摩尔体积大于22.4L/mol,故11.2L混合物的物质的量小于0.5mol,则含有的碳原子个数小于0.5NA个,故A错误;
B、7.1g氯气的物质的量为0.1mol,而1mol氯气与氢氧化钠转移1mol电子,故0.1mol氯气中转移0.1mol电子即0.1NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为2mol,则含有6mol原子即6NA个,故C正确;
D、氨水中存在平衡:NH3+H2O?NH3•H2O,故溶液中含有的氨气分子个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
20.下列有机化合物命名正确的是( )
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
| A. | 只有②③ | B. | 只有③④ | C. | 都正确 | D. | 都错误 |
18.某有机物的结构如图所示,下列说法正确的是( )


| A. | 与乙苯互为同系物 | B. | 分子中共直线的原子最多有4个 | ||
| C. | 分子中共平面的碳原子最多有13个 | D. | 与甲苯互为同分异构体 |
5.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4•6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的 pH 如下表.
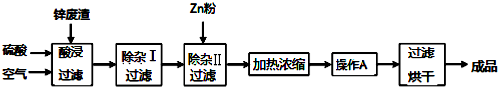
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+.为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.为控制上述pH范围可选择加入的试剂或药品是AD.
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于6.
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Fe3+(填离子符号)先沉淀,Ksp[Fe(OH)2]>Ksp[Cu(OH)2](填“>”、“=”或“<”)

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+.为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.为控制上述pH范围可选择加入的试剂或药品是AD.
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于6.
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Fe3+(填离子符号)先沉淀,Ksp[Fe(OH)2]>Ksp[Cu(OH)2](填“>”、“=”或“<”)
2.下列事实不用原电池原理解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 | |
| D. | 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
19.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1的Ⅰ、Ⅱ所示: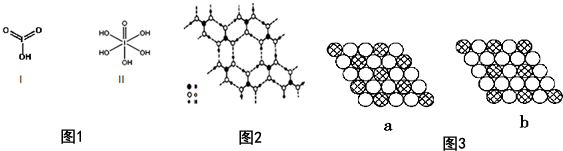
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图2).则1molH3BO3的晶体中有3 mol氢键.
硼酸溶于水生成弱电解质一水合硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为共价键、配位键.
(6)如图所示的二维平面晶体示意图3中表示化学式为AX3的是b.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图2).则1molH3BO3的晶体中有3 mol氢键.
硼酸溶于水生成弱电解质一水合硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为共价键、配位键.
(6)如图所示的二维平面晶体示意图3中表示化学式为AX3的是b.
20.下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是( )
①品红溶液②酸性KMnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉-碘溶液.
①品红溶液②酸性KMnO4溶液③溴水④滴入酚酞的烧碱溶液⑤淀粉-碘溶液.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
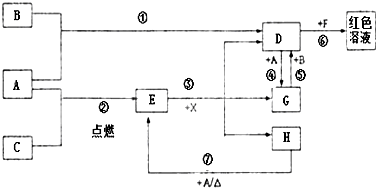 A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).
A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).