题目内容
16.煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境.采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率.相关反应的热化学方程式如下:CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能自发进行的条件是较高温度下.
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp=$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是图1中的C.

(4)通过监测体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生.
(5)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线.则降低该反应体系中SO2生成量的措施有ABC.
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)①用CH4催化还原NOx可以消除氮氧化物的污染.己知:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3l kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
写出CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1245.63 kJ/mol.
②依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是D.
A.C(s)+CO2(g)═2CO(g)△H>0 B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0
C.2H2O(l)═2H2(g)+O2(g)△H>0 D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为O2+4H++4e-=2H2O.
分析 (1)反应能自发进行,应满足△H-T•△S<0;
(2)表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),可根据平衡常数的表达式书写,平衡常数等于气体生成物浓度幂之积除以气体反应物浓度幂之积;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比会随时间发生变化;
(5)由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫;
(6)①依据热化学方程式和盖斯定律计算得到CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式;
②依据原电池的构成原理,下列化学反应在理论上可以设计成原电池需要是自发进行的氧化还原反应;只有D符合;在酸溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应生成二氧化碳和水;
解答 解:(1)反应Ⅰ吸热,则△H>0,由方程式可知△>0,反应能自发进行,应满足△H-T•△S<0,则应在较高温度下进行,故答案为:较高温度下;
(2)由题意可知,反应Ⅱ的Kp=$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$,故答案为:$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、C正确,
故答案为:C;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比随时间会发生变化,有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生,
故答案为:有无二氧化硫可知反应I是否发生,如c(CO2)=c(SO2),则反应II未发生,如c(CO2)>c(SO2),则反应同时发生;
(5)A.向该反应体系中投入石灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;
B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;
C.由图象可知,提高CO的初始体积百分数,增大CaS的质量分数,减少二氧化硫的排放,故C正确;
D.提高反应体系的温度,不利于二氧化硫的减少,故D错误.
故答案为:ABC;
(6)①Ⅰ.CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
Ⅱ.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3l kJ•mol-1
Ⅲ.2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
依据热化学方程式和盖斯定律计算(Ⅰ+Ⅲ)×2-Ⅱ得到反应的热化学方程式为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1245.63 kJ/mol,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1245.63 kJ/mol;
②设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H2O(l)=2H2(g)+O2(g),反应是非自发进行的氧化还原反应,故c不选;
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l),是自发进行的氧化还原反应,可以设计成原电池,故D选;
D反应是甲烷燃料电池,在酸溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH4-8e-+2H2O=CO2+8H+,正极电极反应为:O2+4H++4e-=2H2O;
故答案为:D,O2+4H++4e-=2H2O;
点评 本题涉及化学平衡影响因素、反应热与焓变、原电池原理的考查,侧重于学生的分析能力和计算能力的考查,题目较为综合,涉及面广,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 100mL 1mol•L-1的NaCl溶液 | B. | 150mL 1mol•L-1的MgCl2溶液 | ||
| C. | 200mL 1mol•L-1的HCl溶液 | D. | 10mL 1mol•L-1的AlCl3溶液 |
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
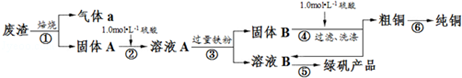
(2)该小组同学设计如图装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗 b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数 d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.
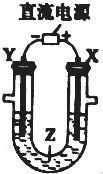
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度变小 | |
| C. | 制取金属镁时,Z是熔融的氧化镁 | |
| D. | 在铁片上镀铜时,Y是纯铜 |
| A. | ③④⑤⑥⑦⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑧ |
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
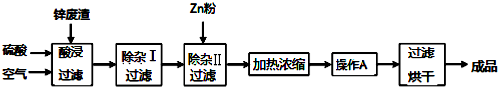
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+.为使 Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.为控制上述pH范围可选择加入的试剂或药品是AD.
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)常温下,已知 Ksp[Zn(OH)2]=5×10-17,某 ZnSO4溶液里c(Zn2+)=0.5mol/L,如果要生成Zn(OH)2沉淀,则应调整溶液 pH 大于6.
(4)当向含相同浓度Cu2+、Fe3+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Fe3+(填离子符号)先沉淀,Ksp[Fe(OH)2]>Ksp[Cu(OH)2](填“>”、“=”或“<”)
| A. | 我们使用合金是因为它比纯金属具有更优良的化学性质 | |
| B. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| C. | 高分子材料可能在特殊情况导电,如聚乙炔 | |
| D. | 可用作荧光灯内壁保护层的纳米氧化铝属于胶体 |
