题目内容
2.下列物质的制备原理设计步骤合理的是( )| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| B. | Fe $→_{点燃}^{Cl_{2}}$ FeCl2$\stackrel{NaOH溶液}{→}$ Fe(OH)2 | |
| C. | AlCl3(溶液)$\stackrel{蒸发}{→}$ AlCl3$\stackrel{电解}{→}$ Al | |
| D. | NaCl(饱和溶液)$\stackrel{依次通入NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 |
分析 A、硫在氧气中燃烧生成二氧化硫;
B、铁在氯气中燃烧生成氯化铁;
C、氯化铝是共价化合物;
D、依据侯氏制碱法原理解答.
解答 解:A、硫在氧气中燃烧生成二氧化硫,得不到三氧化硫,故A错误;
B、铁在氯气中燃烧生成氯化铁,而不是氯化亚铁,故B错误;
C、氯化铝是共价化合物,工业上是用电解熔融的氧化铝得到铝,故C错误;
D、首先通入氨气,增加二氧化碳的溶解度,所以选通氨气,再通二氧化碳,得到溶解度极小的碳酸氢钠,碳酸氢钠不稳定,加热得到碳酸钠,故D正确;
故选D.
点评 本题考查了元素及其化合物的性质,熟悉相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
9.对下列实验的现象描述及其解释均正确的是( )
| 选项 | 实验 | 现象 | 解释 |
| A | 向新制氯水中滴加紫色石蕊试液 | 溶液变为红色且保持不变 | 新制氯水具有酸性 |
| B | SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 符合复分解反应发生条件 |
| C | 无色溶液中滴加FeCl3溶液和CCl4,振荡、静置 | 下层显紫色 | 原溶液中含有I- |
| D | 将少量酸性高锰酸钾溶液滴入乙酸溶液中 | 溶液仍为无色 | 高锰酸钾发生还原反应 |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关说法不正确的是( )
| A. | 酶是一种蛋白质 | B. | 蛋白质是有机高分子化合物 | ||
| C. | 蛋白质的基本组成单位为氨基酸 | D. | 氨基酸是羧酸,显酸性 |
10.室温下,分别用0.1mol•L-1溶液进行下列实验,结论正确的是( )
| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
14.下列说法中,不正确的是( )
| A. | “水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成 了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故 | |
| B. | 水的物理性质十分特殊.水的比热容较大,水结成冰后密度变小,水的熔沸点较高等特殊 性质是由于水分子间存在一种被称为氢键的特殊的分子间作用力 | |
| C. | 铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点 | |
| D. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在 游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材 料,最有潜力的应用是成为硅的替代品,用来生产未来的超级计算机 |
11.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
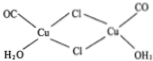 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题: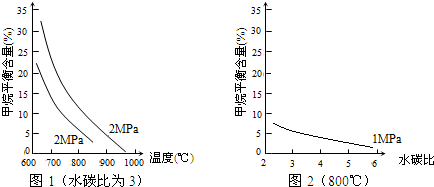
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2.