题目内容
10.室温下,分别用0.1mol•L-1溶液进行下列实验,结论正确的是( )| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
分析 A.NaHC2O4溶液显酸性,则HC2O4-的电离程度大于水解程度;
B.溶液的pH=7,则c(H+)=c(OH-),根据混合液中的电荷守恒判断;
C.设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:$\frac{0.1mol/L×2×1L-0.1mol/L×1L}{2L}$=0.05mol/L;
D.加入氯化铵后,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则氢氧根离子浓度减小,结合氨水的电离平衡常数分析.
解答 解:A.NaHC2O4溶液显酸性,则HC2O4-的电离程度大于水解程度,所以c(C2O42-)>c(H2C2O4),则溶液中微粒的浓度关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故A错误;
B.向NaHCO3溶液中通CO2至pH=7,c(H+)=c(OH-),溶液中电荷守恒为:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),则c(Na+)=c(HCO3-)+2c(CO32-),故B正确;
C.向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液,设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:$\frac{0.1mol/L×2×1L-0.1mol/L×1L}{2L}$=0.05mol/L,溶液中氢氧根离子浓度不是0.1mol/L,溶液的pH≠13,故C错误;
D.氨水中加入少量NH4Cl固体,铵根离子浓度增大,抑制了一水合氨的电离,导致溶液中氢氧根离子浓度减小,而$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kb}{c(O{H}^{-})}$,Kb不变,所以该比值增大,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的灵活应用能力.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 该溶液中,Na+、H+、Cl-、Mg2+可以大量共存 | |
| B. | 与KSCN溶液反应产生红色沉淀 | |
| C. | 加入铜粉,反应的离子方程式为:Cu+Fe3+=Cu2++Fe2+ | |
| D. | 向该溶液中滴入少量Na2S溶液,反应的离子方程式为:2Fe3++3S2-+6H2O=3H2S↑+2Fe(OH)3↓ |
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
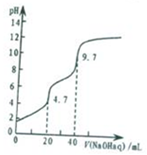 常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )| A. | NaH2PO4溶液呈酸性 | |
| B. | pH=9.7处,c(Na+)>c(HPO42-)>c(OH-)>c(H+) | |
| C. | pH=4.7处,c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| D. | 当2<pH<4.7时,H3PO4的第一步电离平衡常数均相等 |
| A. | 1014-a-2b | B. | 10a+b-14 | C. | 10a-2b | D. | 10a-2b+14 |
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| B. | Fe $→_{点燃}^{Cl_{2}}$ FeCl2$\stackrel{NaOH溶液}{→}$ Fe(OH)2 | |
| C. | AlCl3(溶液)$\stackrel{蒸发}{→}$ AlCl3$\stackrel{电解}{→}$ Al | |
| D. | NaCl(饱和溶液)$\stackrel{依次通入NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 |
| A. | 若a>b,一定存在c(A-)=c(K+) | B. | 若a=2b,一定存在c(A-)>c(K+) | ||
| C. | 若2a=b,一定存在c(OH-)>c(A-) | D. | 若a=b,一定存在c(OH-)=c(H+)+c(HA) |
 .
.