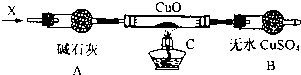
题目内容
7.天然气制油是利用天然气生产汽油和煤油等液体燃料的方法,这种合成油不含硫、氮化合物等杂质,因此也被称作是“绿色燃料”,其主要工作原理包含合成气生成和F-T合成两个过程,其中合成气生成主要化学反应为:主反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ•mol-1
副反应:CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165kJ•mol-1
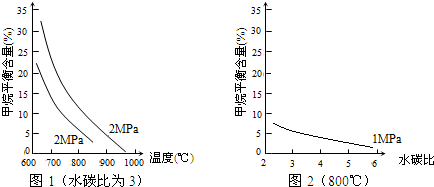
已知合成气生成过程中,温度、压强和水碳比[$\frac{n({H}_{2}O)}{n(C{O}_{2})}$]对甲烷平衡含量(%)的影响如图1:
回答下列问题:
(1)反应CO2(g)+H2(g)?CO(g)+H2O(g)的△H=+41kJ•mol-1.
(2)CH4(g)+H2O(g)?CO(g)+3H2(g)反应自发进行的条件是高温.
若在恒温、恒压时,向该平衡体系中通入氦气平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不移动”),甲烷的转化率将增大,平衡常数不变.(填“增大”、“减小”或“不变”)
(3)其他条件不变,请在图2中用虚线画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间的关系曲线.
(4)已知:在700℃,1MPa时,2mol CH4与2mol H2O在2L可变的密闭容器中发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的平衡转化率为50%,该温度下反应的平衡常数是6.75.
(5)合成气生成过程中,降低反应体系中CO2生成量的措施有B.
A.增大容器体积,降低体系压强
B.在合适的温度区间内控制较低的反应温度
C.适当降低水碳比
D.选择合适、更高效的催化剂
E.向该反应体系中投入活性炭
(6)某研究机构在合成气生成过程中,保持容器体积和原料气比例不变,适当加入CaO和合适的催化剂以获得纯度95%以上的H2,试解释原因催化剂加快反应进行,加入氧化钙和二氧化碳、水反应生成碳酸钙和氢氧化钙,获得纯度95%以上的H2.
分析 (1)依据热化学方程式和盖斯定律计算;
(2)根据图象中可以看出升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动,焓变大于0,反应前后气体体积增大熵变大于0,结合反应蒸发进行的判断依据分析,平衡常数随温度变化;
(3)根据压强不变时,甲烷的百分含量随水碳比增大而减小来画出曲线;
(4)利用三段式计算平衡时各组分的平衡浓度,再根据v=$\frac{△c}{△t}$计算v(H2),代入平衡常数表达式K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$计算其平衡常数;
(5)CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165kJ•mol-1 ,反应是气体体积增大的吸热反应,降低反应体系中CO2生成量,可以改变条件使平衡逆向进行,据此分析判断选项;
(6)保持容器体积和原料气比例不变,适当加入CaO和合适的催化剂以获得纯度95%以上的H2,利用氧化钙的性质分析;
解答 解:(1)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ•mol-1
②CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165kJ•mol-1
盖斯定律计算①-②得到CO2(g)+H2(g)?CO(g)+H2O(g)的△H=+41KJ/mol,
故答案为:+41KJ/mol;
(2)CH4(g)+H2O(g)?CO(g)+3H2(g),反应△H>0,△S>0,反应自发进行的条件是△H-T△S<0,则反应自发进行的条件是高温条件下,
若在恒温恒压时,向该平衡体系中通入氦气,使容器体积变大,平衡向气体体积增大的方向移动,即向正反应方向移动,甲烷转化率增大,平衡常数随温度变化,温度不变平衡常数不变,
故答案为:高温;向正反应方向;增大;不变;
(3)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为 ;
;
故答案为: ;
;
(4)已知:在700℃,1MPa时,2mol CH4与2mol H2O在2L可变的密闭容器中发生反应,CH4的平衡转化率为50%,根据化学平衡三段式计算
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 1.5
平衡浓度(mol/L):0.5 0.5 0.5 1.5
平衡常数K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$=$\frac{0.5×1.{5}^{3}}{0.5×0.5}$=6.75,
故答案为:6.75;
(5)CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165kJ•mol-1 ,反应是气体体积增大的吸热反应,降低反应体系中CO2生成量,平衡逆向进行,
A.增大容器体积,降低体系压强,平衡向气体体积增大的方向进行,平衡正向进行二氧化碳生成量增大,故A错误;
B.反应是吸热反应,降低温度平衡向法人反应方向进行,在合适的温度区间内控制较低的反应温度,使平衡逆向进行,二氧化碳量减少,故B正确;
C.适当降低水碳比,二氧化碳生成量会增大,故C错误;
D.选择合适、更高效的催化剂,只能改变化学反应速率不改变化学平衡,二氧化碳生成量不变,故D错误;
E.向该反应体系中投入活性炭是固体不影响化学平衡移动,故E错误;
故选B,
故答案为:B;
(6)保持容器体积和原料气比例不变,适当加入CaO和合适的催化剂以获得纯度95%以上的H2,催化剂加快反应进行,加入氧化钙和二氧化碳、水反应生成碳酸钙和氢氧化钙,获得纯度95%以上的H2,
故答案为:催化剂加快反应进行,加入氧化钙和二氧化碳、水反应生成碳酸钙和氢氧化钙,获得纯度95%以上的H2;
点评 本题比较综合,涉及反应热计算、化学平衡图象及影响因素、反应速率与平衡常数计算等,是对基础知识的应用,注意掌握盖斯定律计算反应热,难度中等.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案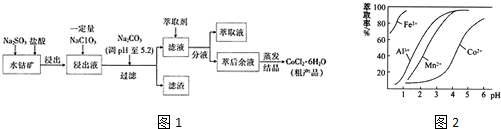
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的化学方程式为Co2O3+Na2SO3+4HCl=2CoCl2+Na2SO4+2H2O
(2)NaClO3在浸出液中发生反应的离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)“加Na2CO3调pH至5.2”,过滤所得滤渣的主要成分为Fe(OH)3、Al(OH)3(填化学式).
(4)萃取剂对金属离子的萃取与溶液pH的关系如图2所示,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+,其使用的最佳pH范围是B(填选项字母)
A.2.0-2.5 B.3.0-3.5C.4.0-4.5 D.5.0-5.5
(5)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.为测定粗产品中CoCl2•6H2O含量.称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是(写两条):①粗产品含有可溶性氯化物,②晶体失去了部分结晶水.
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
| A. | 1014-a-2b | B. | 10a+b-14 | C. | 10a-2b | D. | 10a-2b+14 |
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| B. | Fe $→_{点燃}^{Cl_{2}}$ FeCl2$\stackrel{NaOH溶液}{→}$ Fe(OH)2 | |
| C. | AlCl3(溶液)$\stackrel{蒸发}{→}$ AlCl3$\stackrel{电解}{→}$ Al | |
| D. | NaCl(饱和溶液)$\stackrel{依次通入NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 |
 常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | a点所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | d点所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| A. | 若a>b,一定存在c(A-)=c(K+) | B. | 若a=2b,一定存在c(A-)>c(K+) | ||
| C. | 若2a=b,一定存在c(OH-)>c(A-) | D. | 若a=b,一定存在c(OH-)=c(H+)+c(HA) |