题目内容
9.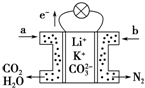 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为CH4,b为CO2 | |
| B. | CO32-向负极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为O2+2H2O+4e-═4OH- |
分析 该原电池为甲烷燃料电池,根据图象中电子流向知,左边电极为负极、右边电极为之间,通入燃料的电极为负极、通入氧化剂的电极为正极,所以a为甲烷、b为氧气,负极反应式为CH4+4CO32--8e-=5CO2+2H2O,正极反应式为O2+2CO2+4e-═2CO32-,据此分析解答.
解答 解:A.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,左边电极是负极、右边电极是正极,所以a是CH4,b为O2,故A错误;
B.原电池放电时,阴离子向负极移动,则碳酸根离子向负极移动,故B正确;
C.电解质为熔融碳酸盐,需要高温条件,故C错误;
D.正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO32-,故D错误;
故选B.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
20.一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是( )
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
17.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内)不能达到目的是( )
| A. | Na2SO3溶液(HCl酸化的BaCl2溶液) | B. | 氯水(AgNO3溶液) | ||
| C. | 漂白粉(稀硝酸) | D. | NaOH溶液(Ba(OH)2溶液) |
4.对于硫酸工业中SO2的催化氧化反应 2SO2+O2$?_{△}^{催化剂}$2SO3,下列说法错误的是( )
| A. | 使用催化剂能加快化学反应速率 | |
| B. | 增大O2浓度可以使SO2转化率达到100% | |
| C. | 降低反应温度,化学反应速率减慢 | |
| D. | 增大O2浓度,化学反应速率增大 |
14.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-.分别取样:①加入浓氢氧化钠溶液,产生有刺激性气味的气体;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
18. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A. | a电极反应式是4OH--4e-═O2↑+2H2O | B. | b电极是阴极 | ||
| C. | 电解过程中水是氧化剂 | D. | b电极附近溶液的pH变大 |
19.下列叙述正确的是( )
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 阳离子一定有氧化性,可能有还原性 | |
| C. | FeCl3溶液和Fe(OH)3胶体的共性是都能产生丁达尔效应 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.