题目内容
2.下列说法正确的是( )| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 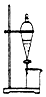 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
分析 A.根据分子式可知,该物质可能是烯烃,也可能是环烷;
B.由图可知,为萃取、分液装置,可分离溶质在不同溶剂中溶解性差异大的混合物,或分离分层的液体;
C.分子间氢键导致沸点较高;
D.苯酚常温下在水中的溶解度不大,苯酚易溶于乙醇等有机溶剂.
解答 解:A.C4H8的结构可能为:CH2=CHCH2CH3、CH2=C(CH3)2、CH3CH=CHCH3、 、
、 ,共有5种同分异构体,故A错误;
,共有5种同分异构体,故A错误;
B.硬脂酸钠、甘油均溶于水,不能利用图中装置分离,故B错误;
C.乙醇和氨气分子间存在氢键,使沸点升高,故C正确;
D.苯酚易溶于乙醇等有机溶剂,苯酚有毒,对皮肤有强烈的腐蚀作用,如果不慎沾到皮肤上应立即用酒精洗涤,故D错误;
故选C.
点评 本题涉及有机物的同分异构体、物质的性质、混合物分离提纯等知识点的考查,把握物质的结构和性质为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
12.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41KJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73KJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171 KJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表一是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
表一:
①X、Y、C三种气体发生反应的化学方程式为Y+3X?2C.
②表中a的取值范围是25.1<a<64.2.
③根据图和表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如表二所示.
表二:
25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3②HNO2③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如图3所示.其中符合曲线Ⅱ的溶液为①③.
②C(s)+2H2(g)?CH4(g)△H=-73KJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171 KJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表一是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
表一:
| 温度/℃C% 压强/MPa | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据图和表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如表二所示.
表二:
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
①NaHSO3②HNO2③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如图3所示.其中符合曲线Ⅱ的溶液为①③.
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,23g NO2含有NA 个氧原子 | |
| B. | 1 L 0.1 mol/L NaHSO3溶液中含有的HSO3-数目为0.1 NA | |
| C. | 1 L pH=1 的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 L CO 和CO2混合气体中含有的氧原子数为0.15NA |
10.有3.92g铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到7.0g固体沉淀物,这种铁的氧化物为( )
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
17.能正确表示下列反应的离子方程式的是( )
| A. | Na2S2O3溶液与H2SO4溶液混合:S2O32-+4H+═SO42-+S↓+2H2O | |
| B. | 硝酸银溶液中滴入少量氨水:Ag++2NH2•H2O═[Ag(NH3)2]++2H2O | |
| C. | AgI悬浊液中滴入适量Na2S溶液:2AgI+S2-═Ag2S+2I- | |
| D. | Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe3++3OH-═Fe(OH)3↓ |
6.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A. | 原氨水物质的量浓度为0.1mol•L-1 | |
| B. | 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L-1 | |
| C. | 反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c( OH-) | |
| D. | 原氨水中:c(NH+4)+c(H+)=c(OH-) |
3.NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 室温下,向1LpH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出137.0kJ热量 |
4.2017年我国自主产权“全球首套煤基乙醇工业化项目”投产成功.“煤基乙醇”就是以煤为原料制备乙醇.乙醇能做燃料,可以添加到汽油中.下列说法错误的是( )
| A. | 煤制乙醇,有利于保护环境,实现能源充分利用 | |
| B. | 煤制乙醇可缓解靠发酵产生乙醇导致的“与人类争粮”的局面 | |
| C. | 等物质的量的乙醇.汽油完全燃烧,乙醇放出的热量多 | |
| D. | 乙醇是世界公认的优良汽油添加剂,可有效改善汽油品质 |
 .
.