题目内容
12.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41KJ•mol-1②C(s)+2H2(g)?CH4(g)△H=-73KJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171 KJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表一是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
表一:
| 温度/℃C% 压强/MPa | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据图和表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如表二所示.
表二:
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
①NaHSO3②HNO2③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如图3所示.其中符合曲线Ⅱ的溶液为①③.
分析 (1)依据热化学方程式和盖斯定律计算②+③-①×2 得到得到所需热化学方程式;
(2)①依据热化学方程式结合盖斯定律计算得到热化学方程式,CO(g)+3H2(g)?CH4(g)+H2O(g),反应是气态体积减小反应,结合影响化学反应速率、催化剂活性、压强对设备需求、经济效益分析;
②Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数;
(3)①图象分析可知XY为反应物,C为生成物,X物质的量消耗3mol-9×0.25mol=0.75mol,Y消耗物质的量=0.25mol,C生成物质的量为0.5mol,物质的量之比等于化学方程式计量数之比,据此写出化学方程式;
②Y+3X?2C,反应是气体体积减小的反应,定义一二法分析图表中数据判断,温度一定C%随压强变化,压强一定,温度变化C%变化得到a的取值;
③25min~40min内图中曲线发生变化,XY减少速率增大,C增加速率增大,可能是增大压强速率增大,平衡正向进行,XY物质的量减小,C物质的量增加;
(4)由电离平衡常数可知,酸性:H2SO3>HNO2>H2CO3>HSO3->HClO>HCO3-,根据强酸制备弱酸,可知H2SO3、HNO2能与碳酸钠反应生成二氧化碳,而HSO3-与HClO与碳酸钠反应只能得到碳酸氢钠.
解答 解:(1)①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
盖斯定律计算②+③-①×2 得到CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162 kJ•mol-1,
故答案为:-162 kJ•mol-1;
(2)①依据盖斯定律计算,
①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
②+③-①得到CO(g)+3H2(g)?CH4(g)+H2O(g),△H=-203KJ/mol
反应是气态体积减小的放热反应,低温高压促进平衡正向进行,图象分析可知,与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低,
故答案为:与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低;
②M点氢气转化率为90%,CO和H2按物质的量比1:3,设为1mol、3mol,结合化学反应三行计算得到平衡物质的量,计算物质的平衡分压=总压×该物质的物质的量分数,得到平衡常数,压强为1.01×105,
CO(g)+3H2(g)?CH4(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.9 2.7 0.9 0.9
平衡量(mol) 0.1 0.3 0.9 0.9
总物质的量=2.2mol,
M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$,
故答案为:$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$;
(3)①图象分析可知XY为反应物,C为生成物,X物质的量消耗3mol-9×0.25mol=0.75mol,Y消耗物质的量=0.25mol,C生成物质的量为0.5mol,物质的量之比等于化学方程式计量数之比,据此写出化学方程式:Y+3X?2C,
故答案为:Y+3X?2C;
②Y+3X?2C,反应是气体体积减小的反应,压强一定,温度升高C的体积分数减小,说明正反应为放热反应,10Mpa,温度升高平衡逆向进行C体积分数减小,a>25.1,图表中温度一定压强增大平衡正向进行,a<64.2,则a取值25.1<a<64.2,
故答案为:25.1<a<64.2;
③25min~40min内图中曲线发生变化,XY减少速率增大,C增加速率增大,可能是增大压强速率增大,平衡正向进行,XY物质的量减小,C物质的量增加,改变的条件是缩小容器体积或增大压强,
故答案为:缩小容器体积或增大压强.
(4)由电离平衡常数可知,酸性:H2SO3>HNO2>H2CO3>HSO3->HClO>HCO3-,根据强酸制备弱酸,可知H2SO3、HNO2能与碳酸钠反应生成二氧化碳,开始加入的酸较小,反应生成碳酸氢盐,溶液中碳酸氢根增大,全部转化为碳酸氢钠时,再滴加酸又转化为二氧化碳,而HSO3-与HClO与碳酸钠反应只能得到碳酸氢钠,符合曲线Ⅱ,
故答案为:①③.
点评 本题考查了化学反应热化学方程式和焓变的计算分析,平衡影响因素、平衡常数计算、图象变化和数据变化的判断、弱酸的电离平衡,侧重考查学生信息获取与知识迁移运用,注意盖斯定律计算,题目难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案( )
| A | ||
| B | ||
| C |
| A. | A是一种活泼金属元素 | |
| B. | C的最高价氧化物的水化物是强酸 | |
| C. | B的氢氧化物是强碱 | |
| D. | C的最高价氧化物对应的水化物能与NaOH溶液反应 |

| A. | 若X为锌棒,开关K置于M处,为外加电流阴极保护法 | |
| B. | 若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法 | |
| C. | 若X为锌棒,开关K置于M处,Zn极发生:Zn-2e-→Zn2+ | |
| D. | 若X为碳棒,开关K置于N处,X极发生还原反应 |

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
(1)A、B、C三种元素形成的化合物含有的化学键类型是离子键、(极性)共价键.
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(4)写出实验室制取单质E的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)C和D两元素形成的单质活泼性较强的是(写元素符号)Na,你的判断依据是Na可与冷水剧烈反应,Al不与水反应.
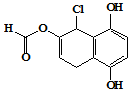
| A. | 不能发生银镜发应,能发生水解反应 | |
| B. | 1mol 该物质最多可与含2mol溴单质的浓溴水反应 | |
| C. | 1mol 该物质最多可与4molNaOH反应 | |
| D. | 与Na、NaHCO3、Na2CO3均能发生反应 |
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. |  用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |