题目内容
6.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )| A. | 原氨水物质的量浓度为0.1mol•L-1 | |
| B. | 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L-1 | |
| C. | 反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c( OH-) | |
| D. | 原氨水中:c(NH+4)+c(H+)=c(OH-) |
分析 pH=1的盐酸,其浓度为0.1mol/L,而pH=11的氨水浓度大于0.001mol/L,二者等体积混合恰好反应说明生成氯化铵,二者浓度相等,结合物料守恒和电荷守恒分析解答.
解答 解:A.二者等体积混合恰好反应说明二者物质的量浓度相等,则原氨水物质的量浓度为0.1mol•L-1,故A正确;
B.混合溶液与原氨水体积相比,体积增大一倍,所以根据物料守恒得c(NH4+)+c(NH3•H2O)+c(NH3)=0.05 mol•L-1,故B错误;
C.氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,所以c(H+)>c(OH-),根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以得c(NH4+)<c(Cl-),盐溶液中铵根离子水解较微弱,所以c(NH4+)>c(H+)则离子浓度大小顺序是c(Cl-)>c(NH+4)>c(H+)>c( OH-),故C正确;
D.任何溶液中都存在电荷守恒,所以原氨水溶液中存在电荷守恒c(NH+4)+c(H+)=c(OH-),故D正确;
故选B.
点评 本题考查酸碱混合的计算,为高频考点,把握酸碱恰好反应时生成氯化铵判断浓度关系为解答的关键,侧重分析与应用能力的考查,注意盐类水解及电荷守恒应用,题目难度不大.

练习册系列答案
相关题目
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素,Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
5.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H;下表所列数据是该反应在不同温度下的化学平衡常数(K).
①写出该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$.
②下列措施可以加快反应速率且能提高CO转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出c.增大压强 d.加入催化剂 e.降低温度
③在300℃时,将2molCO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将向正反应方向进行 (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”).
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O.
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01mol•L-1(25℃下测定),则理论上消耗氧气的体积为56mL(标况下).
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H;下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②下列措施可以加快反应速率且能提高CO转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出c.增大压强 d.加入催化剂 e.降低温度
③在300℃时,将2molCO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将向正反应方向进行 (填“向正反应方向进行”“向逆反应方向进行”或“处于平衡状态”).
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O.
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaC1溶液的体积为1L,溶液中的OH-物质的量浓度为0.01mol•L-1(25℃下测定),则理论上消耗氧气的体积为56mL(标况下).
2.下列说法正确的是( )
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 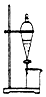 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
1.不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.下面是某些短周期元素的X值.
(1)通过分析X值的变化规律,确定N、Mg的X值范围:0.93<X(Mg)<1.57;2.55<X(N)<3.44.
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为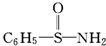 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测X值与原子半径的关系是同周期(或同主族)元素,x值越大,原子半径越小.
(3)某有机物结构简式为
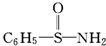 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是共价键
(5)预测元素周期表中,X值最小的元素位置第六周期第ⅠA族(放射性元素除外).
11. 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
18.化学与我们的生活息息相关,下列有关说法正确的是( )
| A. | SO2、NO2都是酸性氧化物,分别能形成硫酸型酸雨和硝酸型酸雨 | |
| B. | 明矾[KAl(SO4)2•l2H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| C. | 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点 | |
| D. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 |
15.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
16.某原子电子排布式为1s22s22p3,下列说法正确的是( )
| A. | 该元素位于第二周期 IIIA族 | |
| B. | 核外有3种能量不同的电子 | |
| C. | 最外层电子占据3个轨道 | |
| D. | 最外层上有3种运动状态不同的电子 |