题目内容
3.NA代表阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 室温下,向1LpH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出137.0kJ热量 |
分析 A.醋酸为弱酸,加水稀释后醋酸的电离程度增大,则氢离子数目增大;
B.乙酸与乙醇发生酯化反应为可逆反应,可逆反应不能进行到底;
C.气体状态未知,气体摩尔体积Vm不确定;
D.缺少乙烯和氢气的物质的量,无法确定放出热量.
解答 解:A.室温下1LpH=1的醋酸溶液中氢离子的物质的量为0.1mol,加水稀释后醋酸的电离程度增大,则氢离子的物质的量大于0.1mol,所得溶液中H+数目大于0.1NA,故A正确;
B.60g乙酸物质的量为1mol,与足量乙醇发生酯化反应,因为酯化反应为可逆反应,所以充分反应后断裂的C-O键数目小于NA,故B错误;
C.气体状态未知,Vm不确定,无法计算产生氢气的物质的量,无法计算乙醇分子中共价键总数,故C错误;
D.已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,该反应说明生成1mol乙烷放出137kJ热量,没有告诉乙烯与H2的量,无法计算反应热,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
则元素Y第一电离能大于X的原因是Mg为3s2构型,完全充满状态,是一种稳定结构;
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
2.下列说法正确的是( )
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 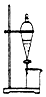 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
11. 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
18.化学与我们的生活息息相关,下列有关说法正确的是( )
| A. | SO2、NO2都是酸性氧化物,分别能形成硫酸型酸雨和硝酸型酸雨 | |
| B. | 明矾[KAl(SO4)2•l2H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| C. | 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点 | |
| D. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 |
8.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-) | |
| B. | 25℃时,0.1mol•L-1醋酸溶液PH=a,0.01mol•L-1醋酸溶液PH=b,则b=a+1 | |
| C. |  常温下,图表示以酚酞作指示剂,用0.1mol•L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性 | |
| D. | 向0.1mol•L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
15.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
13.下列现象不适宜用勒夏特列原理解释的是( )
| A. | 工业上用Na2CO3溶液浸泡水垢 | B. | 夏天的食物更易腐败变质 | ||
| C. | 将氨水保存在温度较低处 | D. | 热的纯碱溶液去除油污效果更好 |