题目内容
19.现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为放热反应,m+n>p(填“>”“=”“<”).
(2)减压时,A的质量分数增大.(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率增大,B的转化率减小.
(4)若加入催化剂,平衡时气体混合物的总物质的量不变.
分析 (1)升高温度时,B的转化率变大,可知升高温度平衡正向移动;当减小压强时,混合体系中C的质量分数也减小,可知减小压强平衡逆向移动;
(2)由信息可知,减小压强,平衡逆向移动;
(3)若加入B(体积不变),平衡正向移动,促进A的转化,但B的总量增大;
(4)加入催化剂,平衡不移动.
解答 解:(1)升高温度时,B的转化率变大,可知升高温度平衡正向移动,正反应为吸热反应,则逆反应为放热反应;当减小压强时,混合体系中C的质量分数也减小,可知减小压强平衡逆向移动,即该反应为气体体积减小的反应,则m+n>p,
故答案为:放;>;
(2)由信息可知,减小压强,平衡逆向移动,A为反应物,则A的质量分数增大,
故答案为:增大;
(3)若加入B(体积不变),平衡正向移动,促进A的转化,但B的总量增大,则A的转化率增大,B的转化率减小,
故答案为:增大;减小;
(4)加入催化剂,平衡不移动,则平衡时气体混合物的总物质的量不变,
故答案为:不变.
点评 本题考查化学平衡,为高频考点,把握温度、压强对平衡移动的影响、转化率的判断为解答的关键,侧重分析与应用能力的考查,注意(1)中判断逆反应的热量变化,题目难度不大.

练习册系列答案
相关题目
10.反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
4.汽车尾气净化器中发生的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如表:下列说法正确是( )
| 容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
| NO | CO | N2 | CO2 | N2 | CO2 | ||
| I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
| II | 400 | 0.4 | 0.4 | 0 | 0 | ||
| III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
| A. | 该反应的△S<0、△H<0 | |
| B. | 容器I中达到平衡所需时间2s,则v(N2)=0.06 mol•L-1•S-1 | |
| C. | 达到平衡时,体系中c(CO)关系:c(CO,容器 II)>2c(CO,容器I) | |
| D. | 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆 |
1.下列关于钠的说法,正确的是( )
| A. | 金属钠与氧气反应,条件不同产物不同 | |
| B. | 金属钠着火可用水扑灭 | |
| C. | 少量的钠可保存在汽油里 | |
| D. | 钠的化学性质活泼,可从硫酸铜溶液中置换出铜 |

 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题: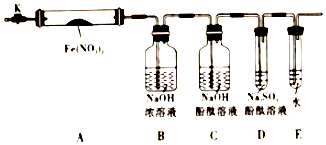 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想: