题目内容
14. 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:甲:Fe2O3、NO2 乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2 丁:FeO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是不符合氧化还原反应原理.
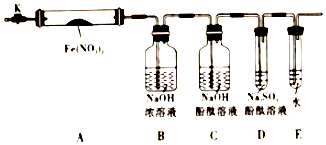
针对上述猜想,设计如图16所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①仪器连接后,放人固体试剂之前,应检验装置的气密性
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,通入N2充满整个装置,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3)实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有Fe2O3、NO2.
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是O2在通过装置B时已参与反应.
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于$\frac{2}{3}$,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式4Fe(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑,通入O2的物质的量为0.0025mol.
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究.写一点不足之处:在A和B处加一个防倒吸的装置或者产生的气体不易收集.
分析 (1)根据氧化还原反应化合价升降相等判断;
(2)①反应前检验装置的气密性;
②甲、乙、丙中都有氧气,避免空气中氧气干扰;
(3)①以Fe(NO3)2为研究对象,称取Fe(NO3)2固体3.6g置于A中,观察到A中有红棕色气体出现为二氧化氮,C、D中未见明显变化.待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g,取少量剩余固体于试管中,加人适量水,未见明显现象,说明生成氧化铁;
②D中亚硫酸钠具有还原性,能够和氧气反应生成硫酸钠,溶液褪色;二氧化氮和氢氧化钠溶液反应生成一氧化氮,一氧化氮会消耗氧气;
③某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于$\frac{2}{3}$,NO2和O2按4:1完全溶于溶液中,说明硝酸铁受热分解生成二氧化氮、氧气且二氧化氮和氧气比值大于4:1,通入一定量的O2后,一氧化氮气体全部被吸收,NO和O2按照4:3生成硝酸,结合化学方程式定量关系计算;
④AB装置间易发生倒吸;
解答 解:(1)由于产物中化合价只有降低情况,没有升高,不满足氧化还原反应的特征,
故答案为:不符合氧化还原反应原理;
(2)①实验前需要检验装置的气密性,方法是关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,证明装置气密性良好,
故答案为:检验装置的气密性;
②由于甲乙丙猜想中产物都有氧气,没有氮气,用氮气排出装置中空气避免对产物氧气检验的干扰,称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,通入N2充满整个装置,后再关闭K,用酒精灯加热,
故答案为:通入N2充满整个装置;
(3)①以Fe(NO3)2为研究对象,称取Fe(NO3)2固体3.6g置于A中,观察到A中有红棕色气体出现为二氧化氮,C、D中未见明显变化.待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g,取少量剩余固体于试管中,加人适量水,未见明显现象,说明生成氧化铁,根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有Fe2O3、NO2,
故答案为:Fe2O3、NO2;
②亚硫酸钠和氧气的反应,反应方程式是:2Na2SO3+O2=2Na2SO4,在B装置中,二氧化氮和氢氧化钠溶液反应生成一氧化氮,生成的一氧化氮消耗了氧气,
故答案为:O2在通过装置B时已参与反应;
③Fe(NO3)2固体3.6g,物质的量n=$\frac{3.6g}{360g/mol}$=0.01mol,氮元素化合价+5价变化为+4价,氧元素化合价-2价变化为0价,生成1molO2电子转移4mol,生成NO2应为4mol,但将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于$\frac{2}{3}$,通入一定量的O2后,气体全部被吸收,说明二氧化氮和氧气物质的量之比大于4,:1,说明铁+2价变化为+3价,电子守恒和原子守恒得到化学方程式为:4Fe(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑,3.6g硝酸铁反应生成NO20.02mol,和0.0025molO2,溶于水剩余NO20.01mol,全部溶于水需要再通入0.0025mol,
故答案为:4Fe(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑; 0.0025mol;
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究,在A和B处加一个防倒吸的装置或者产生的气体不易收集,
故答案为:在A和B处加一个防倒吸的装置或者产生的气体不易收集;
点评 本题探究硝酸镁分解产物,提出假想,通过实验验证,涉及了化学方程式的书写、加热操作的考查,题目难度中等.

I.测定牙膏中摩擦剂碳酸钙的含量:利用如图所示装置进行实验,充分反应后,通过测定C中生成沉淀的质量来确定样品中碳酸钙的质量分数.图中夹持仪器略去.
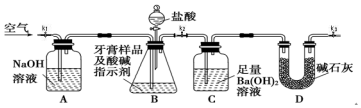
依据实验过程回答下列问题:
(1)以下检查整套装置气密性的操作正确的是a(填字母代号).
a.组装好仪器后,关闭K1和K3、打开K2,分液漏斗中装水.打开分液漏斗的两个活塞,若漏斗中水下滴一会后停止,且液面不再降低,则整套装置不漏气.
b.裝好药品后,关闭K1和K3、打开K2.打开分液漏斗的两个活塞,若漏斗中盐酸下滴一会后停止,且液面不再降低,则整套装置不漏气.
c.短时间轻微加热B,若A中溶液进入长导管,C中长导管冒气泡,则整套装置不漏气.
(2)实验过程中需持续缓慢通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收.
(3)盐酸有一定程度的挥发性,为什么实验时不在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置?碳酸氢钠虽能吸收盐酸,但也产生CO2,HCl即使进入装置C中,由于Ba(OH)2是足量的,就会被Ba(OH)2中和,不会溶解BaCO3.
(4)实验中准确称取20.00g样品三份,进行三次测定,测得BaCO3平均质量为7.88g.则样品中碳酸钙的质量分数为20.0%.
II.为确定该牙膏摩擦剂中氢氧化铝的存在,请设计实验.
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,其逆反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数的值为:2.
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T1时0~10 min NO2的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | T2时CH4的平衡转化率为70.0% | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大 |
表所列数据是该反应在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A(填序号):
A.正向移动 B.逆向移动 C.处于平衡状态 D.无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D在元素周期表中的位置第三周期第VA族,若H的一种同位素中子数为5,则其原子符号是510B,B元素的原子结构示意图是
 ,G与F分别形成的简单离子半径大小关系为N3->Na+.
,G与F分别形成的简单离子半径大小关系为N3->Na+.(2)F与A形成的化合物电子式是:
 、
、 .
.(3)用电子式表示F2I的形成过程:
 ;
;(4)F与J形成的化合物电子式为
 ,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..
,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.. | A. | 10:1 | B. | 1:10 | C. | 1:2 | D. | 2:1 |