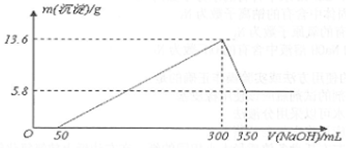
题目内容
19.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子 | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
分析 A、溶液体积不明确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出氖气的物质的量,然后根据氖气为单原子分子来分析;
D、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒个数小于0.1NA个,故B错误;
C、标况下11.2L氖气的物质的量为0.5mol,而氖气为单原子分子,故0.5mol氖气中含0.5NA个氖原子,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含阴离子为0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
7.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 光导纤维属于硅酸盐产品 |
14.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向饱和Na2CO3溶液中通入过量CO2
④向NaAlO2溶液中通入过量CO2.
①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向饱和Na2CO3溶液中通入过量CO2
④向NaAlO2溶液中通入过量CO2.
| A. | ①③④ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④ |
11.在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
H2(g)+Cl2(g)═2HCl(g)△H2
2H2O(g)+2Cl2(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H2
2H2O(g)+2Cl2(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A. | △H3═△H1+2△H2 | B. | △H3═△H1+△H2 | C. | △H3═△H1-2△H2 | D. | △H3═△H1-△H2 |
8.某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是( )
| A. | Zn为电池的正极 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 该电池放电过程中电解质溶液浓度不变 |
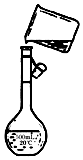 某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题: