题目内容
11.在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1H2(g)+Cl2(g)═2HCl(g)△H2
2H2O(g)+2Cl2(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A. | △H3═△H1+2△H2 | B. | △H3═△H1+△H2 | C. | △H3═△H1-2△H2 | D. | △H3═△H1-△H2 |
分析 由①2H2O(g)=O2(g)+2H2(g)△H1
②H2(g)+Cl2(g)═2HCl(g)△H2
结合盖斯定律可知,①+②×2得到2H2O(g)+2Cl2(g)═4HCl(g)+O2(g),以此来解答.
解答 解:由①2H2O(g)=O2(g)+2H2(g)△H1
②H2(g)+Cl2(g)═2HCl(g)△H2
结合盖斯定律可知,①+②×2得到2H2O(g)+2Cl2(g)═4HCl(g)+O2(g),则△H3═△H1+2△H2,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应之间的关系、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意焓变的关系与反应的关系对应,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.胶体区别于其他分散系的本质特征是( )
| A. | 光束穿过胶体时形成一条光亮的“通路” | |
| B. | 胶体粒子直径大小在1~100nm之间 | |
| C. | 胶体粒子可以透过滤纸 | |
| D. | 胶体粒子带有一定数目的电荷 |
19.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子 | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
6.下列指定反应的离子方程式正确的是( )
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
16.有机物A的结构简式如图:下列有关A的性质叙述中,正确的是( )
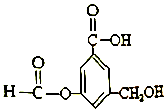

| A. | A 与金属钠完全反应时,两者反应的物质的量之比为1:3 | |
| B. | lmolA最多能与5mol氢气发生反应,反应类型是加成反应 | |
| C. | 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol | |
| D. | A既能与羧基反应,又能与醇反应,还能发生水解反应和缩聚反应 |
3.下列有关氧元素及其化合物的化学用语表示正确的是( )
| A. | 质子数为 8、中子数为 10 的氧原子:${\;}_{8}^{10}$O | |
| B. | 过氧化钠的电子式: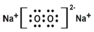 | |
| C. | 氧原子的电子排布图:1s22s22p4 | |
| D. | 次氯酸的结构式:H-Cl-O |
20.实验室制取乙酸乙酯:CH3COOH+C2H5OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.下列操作或装置能达到实验目的是( )
| A | B | C | D |
 | 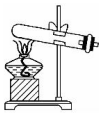 |  |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
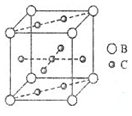 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.