题目内容
14.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )①在敞口容器中将金属钠投入到FeC12溶液中
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液
③向饱和Na2CO3溶液中通入过量CO2
④向NaAlO2溶液中通入过量CO2.
| A. | ①③④ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④ |
分析 ①钠和水反应生成氢氧化钠,氢氧化钠与氯化亚铁反应生成不稳定的氢氧化亚铁,易被氧化生成氢氧化铁;
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液,得到偏铝酸钠;
③向饱和Na2CO3溶液中通入过量CO2,可得到碳酸氢钠;
④向NaAlO2溶液中通入过量CO2,生成氢氧化铝沉淀.
解答 解:①钠和水反应生成氢氧化钠,氢氧化钠与氯化亚铁反应生成不稳定的氢氧化亚铁,易被氧化生成氢氧化铁,为红褐色沉淀,故错误;
②向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液,得到偏铝酸钠,没有沉淀生成,故错误;
③向饱和Na2CO3溶液中通入过量CO2,可得到碳酸氢钠,由于碳酸氢钠的溶解度较小,可得到沉淀,故正确;
④向NaAlO2溶液中通入过量CO2,生成氢氧化铝沉淀,氢氧化铝不溶液碳酸,故正确.
故选D.
点评 本题考查了物质间的反应,为高频考点和常见题型,明确物质的性质是解本题关键,根据物质的性质来分析解答,熟练掌握元素化合物之间的反应,题目难度不大

练习册系列答案
相关题目
4.下列方程式书写正确的是( )
| A. | CaCO3的电离方程式:CaCO3═Ca2+CO32- | |
| B. | NaHS水解:HS-+H2O═H3O++S2- | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
5.能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化.请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为391kJ/mol.
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景.已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)═H2O(l)△H=b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b)kJ/mol.
(3)已知:HCN(aq)与NaOH(aq)反应的焓变△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的焓变△H=-55.6kJ•mol-1.则HCN在水溶液中电离的焓变△H等于+43.5kJ•mol-1.
(4)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.83kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ•mol-1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为0.1mol(计算结果保留一位小数)
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为391kJ/mol.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=a kJ/mol
②H2O(g)═H2O(l)△H=b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=(a+4b)kJ/mol.
(3)已知:HCN(aq)与NaOH(aq)反应的焓变△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的焓变△H=-55.6kJ•mol-1.则HCN在水溶液中电离的焓变△H等于+43.5kJ•mol-1.
(4)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.83kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.9kJ•mol-1;
若氢气与一氧化碳的混合气体完全燃烧可生成5.4g H2O(l),并放出114.3kJ的热量,则混合气中CO的物质的量为0.1mol(计算结果保留一位小数)
2.胶体区别于其他分散系的本质特征是( )
| A. | 光束穿过胶体时形成一条光亮的“通路” | |
| B. | 胶体粒子直径大小在1~100nm之间 | |
| C. | 胶体粒子可以透过滤纸 | |
| D. | 胶体粒子带有一定数目的电荷 |
9.下列叙述:
①我国科学家在世界上第一次人工合成结晶牛胰岛素;
②最早发现电子的是英国科学家道尔顿;
③测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出;
④荷兰化学家范特霍夫提出碳原子成键的新解释,成功地解决了二取代甲烷只有一种结构的问题;
⑤首先在实验室合成尿素的是维勒,
其中正确的是( )
①我国科学家在世界上第一次人工合成结晶牛胰岛素;
②最早发现电子的是英国科学家道尔顿;
③测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出;
④荷兰化学家范特霍夫提出碳原子成键的新解释,成功地解决了二取代甲烷只有一种结构的问题;
⑤首先在实验室合成尿素的是维勒,
其中正确的是( )
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
19.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子 | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
6.下列指定反应的离子方程式正确的是( )
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
3.下列有关氧元素及其化合物的化学用语表示正确的是( )
| A. | 质子数为 8、中子数为 10 的氧原子:${\;}_{8}^{10}$O | |
| B. | 过氧化钠的电子式: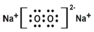 | |
| C. | 氧原子的电子排布图:1s22s22p4 | |
| D. | 次氯酸的结构式:H-Cl-O |