题目内容
8.已知Al(OH)3胶粒能够净水,则Fe(OH)3胶粒能(填“能”或“不能”)净水.分析 Al(OH)3胶粒能净水,是由于其带正电荷,中和水体中带负电的泥沙胶粒,共同凝为沉淀.
解答 解:Al(OH)3胶粒能净水,是由于其带正电荷,中和水体中带负电的泥沙胶粒,共同凝为沉淀.Fe(OH)3胶粒也带正电荷,故有相同的净水效果,故答案为:能.
点评 本题考查胶体制备以及胶体的性质,为高频考点,侧重基础知识的考查,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
10.香豆素是一种天然香料,也可通过下列反应制备:

下列有关说法中正确的是( )

下列有关说法中正确的是( )
| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
19. 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入
25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为①③⑤⑥
(2)取用25.00 mL待测NaOH溶液应用以下乙(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失,
则会导致所测氢氧化钠溶液浓度偏大(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
16.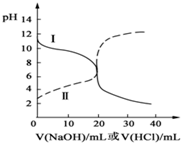 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
3.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从①组实验分析,HA是弱酸(填“强酸”或“弱酸”).
(2)②组实验表明,c大于0.2(填“大于”、“小于”或“等于”).混合液中离子浓度c(A-)与c(Na+)的大小关系是c(A-)=c(Na+).
(3)从③组实验结果分析,说明HA的电离程度大于(填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)①组实验所得的混合溶液中,下列算式的精确结果是:c(OH-)-c(HA)=10-9mol/L.
13.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快.某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
[表1]
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
[表2]
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
[表3]
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
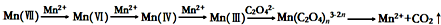
上述实验中,实验Ⅰ可证明这个历程是可信的.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
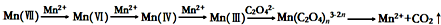
上述实验中,实验Ⅰ可证明这个历程是可信的.
20.在298K时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |