题目内容
1.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:①HF(aq)+OH-(aq)?H2O(l)+F(aq)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
在20Ml0.lmol/L的氢氟酸中滴加0.lmol/L的NaOH V mL,下列说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 当V=20 mL时,溶液中:c(OH-)=c(HF)+c(H+) | |
| C. | 当V=20 mL时,溶液中:c(F-)=c(Na+)=0.1mol/L | |
| D. | 当v>0时,溶液中一定存在c(Na+)>c(F-)>c(OH-)>c(H+) |
分析 A.利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,可根据质子守恒判断;
C.当V=20时,恰好反应生成NaF,溶液呈碱性,结合电荷守恒判断;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A错误;
B.当V=20时,恰好反应生成NaF,溶液呈碱性,根据质子守恒可得c(OH-)=c(HF)+c(H+),故B正确;
C.当V=20时,恰好反应生成NaF,应F-水解,则c(F-)<c(Na+)=0.05mol•L-1,故C错误;
D.溶液离子浓度大小关系取决于V,V不同,浓度关系可能不同,溶液也可能呈酸性,所以c(OH-)不一定大于c(H+),故D错误.
故选B.
点评 本题考查酸碱混合的计算和判断,题目难度中等,注意盖斯定律的运用,易错点为D,注意V对溶液酸碱性的影响,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
3.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 0.1mol•L-1的NaOH溶液中含Na+数目为0.1NA | |
| B. | 标准状况下,2.24L乙酸中含碳原子数目为0.2NA | |
| C. | 12gC60中含质子总数为6NA | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数目为0.2NA |
12.下列说法正确的是( )
| A. | 向1ml 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3 | |
| B. | 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性 | |
| C. | 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a |
9.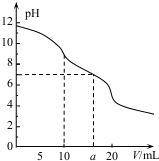 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
16.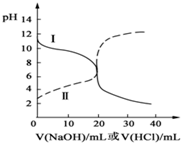 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
6.分子式为C6H12O2的有机物,该物质能发生银镜反应,且在酸性条件下水解为A和B.不考虑立体异构,满足条件的该有机物的同分异构体共有( )
| A. | 8种 | B. | 12种 | C. | 15种 | D. | 20种 |
13.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快.某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
[表1]
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
[表2]
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
[表3]
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
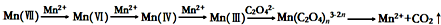
上述实验中,实验Ⅰ可证明这个历程是可信的.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
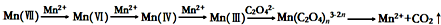
上述实验中,实验Ⅰ可证明这个历程是可信的.
10.在室温下,等体积的酸和碱溶液混合后pH一定小于7的是( )
| A. | pH=3的HNO3与pH=11的KOH溶液 | |
| B. | pH=3的HNO3与pH=11的氨水 | |
| C. | pH=3的H2SO4与pH=11的NaOH | |
| D. | pH=3的CH3COOH 与pH=11的Ba(OH)2溶液 |
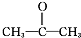 .
.