题目内容
1.下列物质中,物质的量最多的是( )| A. | 3.01×1023个铁原子 | B. | 标准状况下33.6L SO2 | ||
| C. | 1L 1mol/L Na2SO4溶液中的Na+ | D. | 16g氧气 |
分析 A.根据n=$\frac{N}{{N}_{A}}$计算Fe原子物质的量;
B.根据n=$\frac{V}{{V}_{m}}$计算二氧化硫物质的;
C.溶液中钠离子浓度为硫酸钠的2倍,根据n=cV计算钠离子物质的量;
D.根据n=$\frac{m}{M}$计算氧气物质的量.
解答 解:A.3.01×1023个铁原子原子物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol;
B.标准状况下33.6L SO2的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol;
C.1L 1mol/L Na2SO4溶液中的Na+的物质的量为1L×2×1mol/L=2mol;
D.16g氧气的物质的量为$\frac{16g}{32g/mol}$=0.5mol,
故选:C.
点评 本题考查物质的量有关计算,比较基础,掌握以物质的量为中心的计算.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
11.下列化学用语表达正确的是( )
| A. | 丁烷的结构简式为CH3CH2CH2CH3 | B. | 一氯乙烷的结构式为CH3Cl | ||
| C. | 四氯化碳的电子式为 | D. | 苯的分子式为 |
12.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
①据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是液态;分离二者所采取的操作名称是蒸馏.
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.
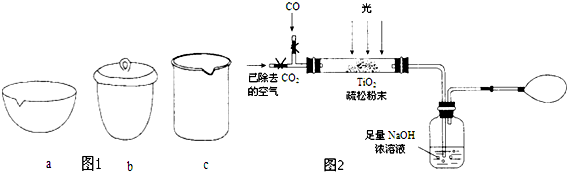
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
9.2012年12月7日日本明治奶粉检测出放射性核素铯13755Cs而被召回,下列有关铯原子(13755Cs)的说法错误的是( )
| A. | 原子序数为55 | B. | 电子数是55 | C. | 中子数是137 | D. | 质量数是137 |
16.在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③3.4gNH3.下列对这三种气体的相关量的关系比较不正确的是( )
| A. | 质量:②>①>③ | B. | 氢原子数:②>①>③ | C. | 体积:②>①>③ | D. | 密度:②>③>① |
6.将a克Fe2O3、Al2O3样品溶解在过量的200mL浓度为0.1mol•L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.4mol•L-1 | D. | 0.8mol•L-1 |
10.加入适量的H2SO4溶液,可使下列离子在溶液中的数目显著减少的是( )
| A. | Cl- | B. | NO3- | C. | Na+ | D. | CO3- |
