题目内容
12.纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4.
Ⅱ.将SiCl4分离,得到纯净的TiCl4.
Ⅲ.向TiCl4中加水,加热,水解得到沉淀TiO2•xH2O.
Ⅳ.将TiO2•xH2O高温分解得到TiO2.
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
②Ⅲ中反应的化学方程式是TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
③如在实验室中完成步骤IV,应将TiO2•xH2O放在坩埚(填字母序号图 1)中加热.
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2.H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的氧化性(填“氧化性”或“还原性”).
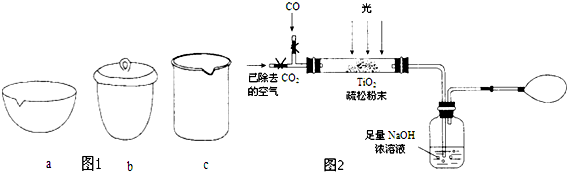
(3)图2是某研究小组用下列装置模拟“生态马路”的部分原理(夹持装置已略去).
①缓慢通入22.4L(已折算成标准状况)CO气体和足量空气,最终测得NaOH溶液增重11g,则CO的转化率为25%.
②实验①中,当CO气体全部通入后,还要再通一会儿空气,其目的是将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
分析 (1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.四氯化钛和四氯化硅熔沸点差别较小,可以采用蒸馏方法将SiCl4分离,得到纯净的TiCl4;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2•xH2O,同时生成HCl;
Ⅳ.将TiO2•xH2O高温分解得到TiO2和水;
①熔沸点差别较小的物质采用蒸馏方法分离;
②由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl;
③Ⅳ为高温分解固体物质,通常在坩埚中进行;
(2)①CxHy、CO等具有还原性,H2O2具有强氧化性;
②双氧水具有强氧化性,能够将一氧化碳氧化成二氧化碳,据此写出反应的化学方程式;
(3)①NaOH溶液增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:$\frac{11g}{44g/mol}$=0.25mol,依据转化率概念计算得到;
②装置中有残留的二氧化碳气体,通一会空气的目的是赶净装置中的二氧化碳被氢氧化钠吸收,减少测定误差.
解答 解:工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.四氯化钛和四氯化硅熔沸点差别较小,可以采用蒸馏方法将SiCl4分离,得到纯净的TiCl4;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2•xH2O,同时生成HCl;
Ⅳ.将TiO2•xH2O高温分解得到TiO2和水;
①熔沸点差别较小的物质采用蒸馏方法分离,根据表中数据知,二者在常温下都是液态,且二者熔沸点差别较小,可以采用蒸馏方法分离,故答案为:液态;蒸馏;
②由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2•xH2O与HCl,反应方程式为TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$ TiO2•xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$ TiO2•xH2O↓+4HCl;
③Ⅳ为高温分解固体物质,通常在坩埚中进行,故选b;
(2)①CxHy、CO等具有还原性,H2O2具有强氧化性,所以双氧水体现氧化性,故答案为:氧化性;
②双氧水具有强氧化性,能够将一氧化碳氧化成二氧化碳,据此写出反应的化学方程式;
(3)①NaOH溶液增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:$\frac{11g}{44g/mol}$=0.25mol,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为:n(CO)=n(CO2)=0.25mol,气体中n(CO)=$\frac{22.4L}{22.4L/mol}$=1mol,CO的转化率=$\frac{0.25mol}{1mol}$×100%=25%,
故答案为:25%;
②装置中有残留的CO2气体,通一会空气,将残留在装置中的CO2气体排出,以便被NaOH溶液吸收,从而减小误差,
故答案为:将生成的CO2气体全部排出被NaOH溶液完全吸收,使实验结果更加精确.
点评 本题考查物质制备实验方案设计,为高频考点,涉及方程式的计算、盐类水解、氧化还原反应等知识点,侧重考查基本理论及基本计算,明确实验基本操作及物质性质是解本题关键,题目难度不大.

| A. | 常温常压下,71g Cl2中所含分子数为NA | |
| B. | 0.1mol/L的H2SO3溶液中,c(H+):c(SO32-)>2:1 | |
| C. | 2L 0.6mol/L的Fe2(SO4)3溶液中,含Fe3+离子总数为2.4NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| A. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子数目是0.4NA | |
| C. | 1mol Cl2,与H2O反应转移NA个电子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
| A. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
| A. | pH=7的溶液是中性 | |
| B. | 中性溶液中一定有c(H+)=1.0×10-7mol•L-1 | |
| C. | 在100℃时,纯水的pH<7,因此显酸性 | |
| D. | c(OH-)=c(H+)的溶液呈中性 |
| A. | 3.01×1023个铁原子 | B. | 标准状况下33.6L SO2 | ||
| C. | 1L 1mol/L Na2SO4溶液中的Na+ | D. | 16g氧气 |
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | Fe(OH)2不稳定,在潮湿的空气中很容易被氧化 | |
| D. | 含Fe2+的溶液滴加KSCN后溶液变红色 |
 .
. (1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)
(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)