题目内容
11.现有以下物质:①KI晶体②液态HCl③醋酸④铜丝⑤CaCO3固体⑥稀硫酸⑦酒精(C2H5OH)⑧熔融KNO3⑨液态SO3.请回答下列问题(用序号):(1)以上物质中能导电的是④⑥⑧.
(2)以上物质中属于电解质的是①②③⑤⑧.
(3)以上物质中属于非电解质的是⑦⑨.
分析 物质导电的条件:含有自由移动的离子或者自由电子;
水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
水溶液中和熔融状态下都不能够导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;
单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.
解答 解:①KI晶体不含自由移动的离子或者自由电子,不导电;水溶液中或熔融状态下能够导电的化合物,是电解质;
②液态HCl不含自由移动的离子或者自由电子,不导电;水溶液中能够导电的化合物,是电解质;
③醋酸不含自由移动的离子或者自由电子,不导电;水溶液中能够导电的化合物,是电解质;
④铜丝含有自由电子,能够导电;是单质,既不是电解质,也不是非电解质;
⑤CaCO3固体不含自由移动的离子或者自由电子,不导电;熔融状态下能够导电的化合物,是电解质;
⑥稀硫酸含自由移动的离子,能够导电;是混合物,既不是电解质,也不是的非电解质;
⑦酒精(C2H5OH)不含自由移动的离子或者自由电子,不导电;水溶液中和熔融状态下都不能够导电的化合物,是非电解质;
⑧熔融KNO3含自由移动的离子,能够导电;水溶液中或熔融状态下能够导电的化合物,是电解质;
⑨液态SO3不含自由移动的离子或者自由电子,不导电;本身不能电离产生自由移动的离子,属于非电解质;
所以:(1)以上物质中能导电的是④⑥⑧;
故答案为:④⑥⑧;
(2)以上物质中属于电解质的是①②③⑤⑧;
故答案为:①②③⑤⑧;
(3)以上物质中属于非电解质的是⑦⑨;
故答案为:⑦⑨;
点评 本题考查了电解质、非电解质的判断,物质导电性的判断,熟悉电解质、非电解质概念是解题关键,注意单质、混合物既不是电解质,也不是非电解质,题目难度不大.

练习册系列答案
相关题目
1.下列物质中,物质的量最多的是( )
| A. | 3.01×1023个铁原子 | B. | 标准状况下33.6L SO2 | ||
| C. | 1L 1mol/L Na2SO4溶液中的Na+ | D. | 16g氧气 |
2.下列有关铁及其化合物的说法中正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | Fe(OH)2不稳定,在潮湿的空气中很容易被氧化 | |
| D. | 含Fe2+的溶液滴加KSCN后溶液变红色 |
19.目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
该小组设计流程如图:
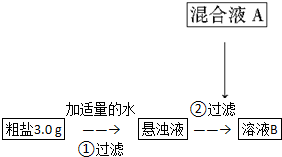
(1)加入混合液A的主要成分是NaOH、Na2CO3(填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液 B.0.1mol•L-1Na2SO3溶液 C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热.
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |

(1)加入混合液A的主要成分是NaOH、Na2CO3(填化学式).
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入NaOH溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成.下列三种溶液,其沉淀效果最好的是A.
A.0.1mol•L-1 Na2CO3溶液 B.0.1mol•L-1Na2SO3溶液 C.0.1mol•L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在1.8×10-7mol•L-1以下.
(4)对溶液B加热并不断滴加6mol•L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C.该操作的目的是除去NaOH和Na2CO3.
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热.
3.下列物质不能由单质之间的化合反应得到的是( )
| A. | NO | B. | NO2 | C. | MgCl2 | D. | CuCl2 |
20.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、K+、NO3-、OH- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | H+、Zn2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、OH- |
1.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子不在同一直线 |