题目内容
4.有关晶体的下列说法中正确的是( )| A. | 分子晶体中共价键越强,熔点越高 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 氯化钠晶体熔化时离子键发生断裂 | |
| D. | 金属晶体熔化时金属键未发生断裂 |
分析 A.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关;
B.原子晶体中共价键的强弱决定其熔点的高低,原子晶体中无分子,不存在分子间作用力;
C.氯化钠为离子晶体,含有离子键;
D.金属晶体熔化必须破坏其中的金属键.
解答 解:A.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关,故A错误;
B.原子晶体中共价键的强弱决定其熔点的高低,所以原子晶体中共价键越强,熔点越高,原子晶体中无分子,不存在分子间作用力,故B错误;
C.氯化钠为离子晶体,含有离子键,熔化时离子键发生断裂,故C正确;
D.金属晶体熔化必须破坏其中的金属键.金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,故D错误;
故选C.
点评 本题考查不同类型晶体及其化学键、物质的性质,明确晶体的构成粒子、晶体类型即可解答,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
14.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法错误的是( )
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的氧化物对应的水化物都是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的强 |
15.某有机物的结构简式如下: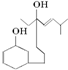 下列说法中正确的是( )
下列说法中正确的是( )
 下列说法中正确的是( )
下列说法中正确的是( )| A. | 该有机物的分子式为C17H29O2 | B. | 分子中有苯环 | ||
| C. | 能够使高锰酸钾溶液褪色 | D. | 只有一个官能团 |
12.向10mL0.10mol•L-1某一元酸HA溶液中滴加等浓度的NaOH溶液,滴加过程溶液的pH随滴加NaOH溶液体积的变化如图所示,下列叙述正确的是( )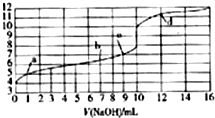

| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |
19.钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求.一种以Na2SO4水溶液为电解液的钠离子电池总反应为:
NaTi2(PO4)3+2Na2NiFeⅡ(CN)6 $?_{充电}^{放电}$ Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6
(注:其中P的化合价为+5,Fe的上标Ⅱ、Ⅲ代表其价态).下列说法不正确的是( )
NaTi2(PO4)3+2Na2NiFeⅡ(CN)6 $?_{充电}^{放电}$ Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6
(注:其中P的化合价为+5,Fe的上标Ⅱ、Ⅲ代表其价态).下列说法不正确的是( )
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| C. | 充电过程中阳极反应式为:2NaNiFeIIⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ(CN)6 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
9. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池中电极b是正极 | |
| B. | 外电路中电子由电极b通过导线流向电极a | |
| C. | 该电池的正极反应为O2+4H++4e-=2H2O | |
| D. | 该电池的总反应:2H2+O2=2H2O |
16.下列说法正确的是( )
| A. | 二氧化硫具有还原性,能与强氧化性的高锰酸钾发生氧化还原反应 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
13.符合下列要求的同分异构体数目(不考虑立体异构)最少的是( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C5H12O的醇 | ||
| C. | 分子式为C5H10O2的羧酸 | D. | 分子式为C5H10O2的酯 |
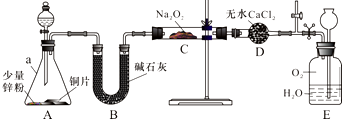 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.