题目内容
12.向10mL0.10mol•L-1某一元酸HA溶液中滴加等浓度的NaOH溶液,滴加过程溶液的pH随滴加NaOH溶液体积的变化如图所示,下列叙述正确的是( )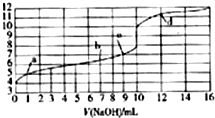
| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 由0.1mol/L的HA酸的pH=4可知,酸HA为弱酸;由于酸和碱均能抑制水的电离,而盐类的水解能促进水的电离,而由a点到b点到c点,随着加入的碱的物质的量增多,溶液中酸HA的量逐渐减少,强碱弱酸盐NaA的量逐渐增多,故对水的影响由抑制逐渐转变为促进;在C点时,加入的NaOH溶液的体积为9mL,此时酸过量;在加入NaOH溶液10mL时,酸碱恰好完全反应,此时为NaA的溶液,但由于是强碱弱酸盐,故溶液显碱性;在d点时,加入的NaOH溶液体积为12mL,故溶液中为NaA和NaOH的混合物,据此分析.
解答 解:A、由0.1mol/L的HA酸的pH=4可知,酸HA为弱酸,故A错误;
B、由a点到b点到c点,随着加入的碱的物质的量增多,溶液中酸HA的量逐渐减少,强碱弱酸盐NaA的量逐渐增多,故对水的影响由开始的抑制逐渐转变为促进,即水的电离程度点a点<b点<c点,故B错误;
C、c点时,加入的NaOH溶液的体积为9mL,此时酸过量,故酸碱没有完全反应,故C错误;
D、在d点时,加入的NaOH溶液体积为12mL,故溶液中为NaA和NaOH的混合物,且n(NaA)>n(NaOH),故溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确.
故选D.
点评 本题考查酸碱混合溶液的定性判断,明确图象中各点的pH及弱电解质的电离影响因素即可解答,注意电离平衡常数只与温度有关,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
3. 120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )
120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )
 120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )
120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )| A. | CH3CH3 | B. | CH3CH2COOH | C. | CH3CH2OH | D. | CH3CH(OH)CH3 |
20.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 其溶液的pH=13 | |
| C. | 用HNO3溶液完全中和后,溶液显中性 | |
| D. | 加入少量NH4Cl固体后,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值变小 |
17.如图是碳的正常循环,但由于过度燃烧化石燃料,造成二氧化碳浓度不断上升.研究和解决二氧化碳捕集、存储和转化问题成为当前化学工作者的重要使命.
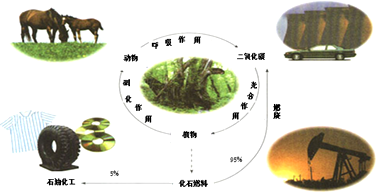
(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能b.化石燃料是可再生的
c.循环过程有氧化还原反应d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)=2CO(g)+O2(g),该反应的△H0>,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)=CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)=2CH3OH(l)+3O2(g)△H=kJ•mol-1.
你认为该方法需要解决的技术问题有:.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
氨基甲酸铵分解反应是吸热反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:4×10-6.
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.


(1)有关碳循环的说法中正确的是ac
a.光合作用是光能转化成化学能b.化石燃料是可再生的
c.循环过程有氧化还原反应d.石油中含乙烯、丙烯,通过加聚反应得到高分子化合物
(2)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)=2CO(g)+O2(g),该反应的△H0>,(选填:>、<、=).
(3)CO2转化途径之一是:利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其它的物质.
2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
3H2(g)+CO2(g)=CH3OH(l)+H2O(1)△H=-137.8kJ•mol-1
则反应:4H2O (1)+2CO2(g)=2CH3OH(l)+3O2(g)△H=kJ•mol-1.
你认为该方法需要解决的技术问题有:.
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2催化转化.
c.二氧化碳及水资源的来源供应
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得的有关数据见下表.( t1<t2<t3)
| 温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
(5)用一种钾盐水溶液作电解质,CO2电催化还原为碳氢化合物(其原理见图).在阴极上产生乙烯的电极反应方程式为:2CO2+12H++12e-=CH2=CH2+4H2O.

4.有关晶体的下列说法中正确的是( )
| A. | 分子晶体中共价键越强,熔点越高 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 氯化钠晶体熔化时离子键发生断裂 | |
| D. | 金属晶体熔化时金属键未发生断裂 |
1.对于反应3Cl2+6KOH(浓)═5KCl+KClO3+3H2O,说法正确的是( )
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | 有3molCl2参加反应,就有6NA个电子转移 | |
| C. | 被还原的氯原子和被氧化的氯原子的个数比是1:1 | |
| D. | 被还原的氯原子和被氧化的氯原子的个数比是5:1 |
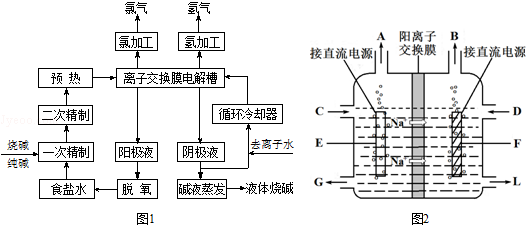
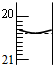 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液: