题目内容
19.钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求.一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3+2Na2NiFeⅡ(CN)6 $?_{充电}^{放电}$ Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6
(注:其中P的化合价为+5,Fe的上标Ⅱ、Ⅲ代表其价态).下列说法不正确的是( )
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| C. | 充电过程中阳极反应式为:2NaNiFeIIⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ(CN)6 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
分析 该原电池放电时,Fe元素化合价由+2价变为+3价,Ti元素化合价由+4价变为+3价,所以负极上Na2NiFeII (CN)6失电子发生氧化反应、正极上NaTi2(PO4)3得电子发生还原反应,充电时,阳极、阴极反应式与正极、负极反应式正好相反,据此分析解答.
解答 解:该原电池放电时,Fe元素化合价由+2价变为+3价,Ti元素化合价由+4价变为+3价,所以负极上Na2NiFeII (CN)6失电子发生氧化反应、正极上NaTi2(PO4)3得电子发生还原反应,充电时,阳极、阴极反应式与正极、负极反应式正好相反,
A.放电时NaTi2(PO4)3在正极得电子而发生还原反应,故A正确;
B.放电时,阳离子向正极移动,所以放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中,故B正确;
C.充电时,阳极失电子发生氧化反应,电极反应式为Ti2(PO4)33--2e-=Ti2(PO4)3-,故C错误;
D.根据电池反应式知,反应过程中钠离子实质上不参加反应,所以钠离子浓度基本不变,故D正确.
故选C.
点评 本题考查化学电源新型电池,明确元素化合价变化与电极名称关系是解本题关键,难点是电极反应式的书写,要结合电解质溶液书写,为高考高频点,也是学习难点.

练习册系列答案
相关题目
4.有关晶体的下列说法中正确的是( )
| A. | 分子晶体中共价键越强,熔点越高 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 氯化钠晶体熔化时离子键发生断裂 | |
| D. | 金属晶体熔化时金属键未发生断裂 |
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解质,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
8.所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.凡是有一个手性碳原子的物质一定具有光学活性.例如,有机化合物( )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
 )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与氢气作用 |
 某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体).
 .
. ;E:
;E: .
. .
.
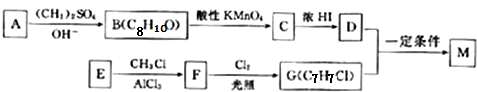
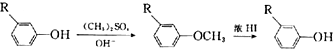
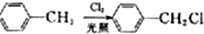
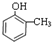 ;E→F的反应类型为取代反应.
;E→F的反应类型为取代反应.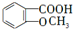 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$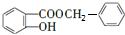 +HCl
+HCl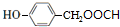 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备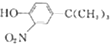 的合成路线:
的合成路线: $→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$
$→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$ $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$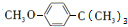 $→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$
$→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$ $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$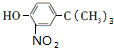 .
.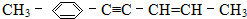 ,共面的碳原子最多有
,共面的碳原子最多有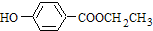 ;
;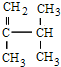 系统法命名的名称为2,3-二甲基-1-丁烯.
系统法命名的名称为2,3-二甲基-1-丁烯.