题目内容
8.下列实验过程中,始终无明显现象的是( )| A. | Cl2通入NaHCO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AlCl3溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
分析 根据物质之间的反应,如生产气体、沉淀或颜色明显变化,则有明显现象;而反应中生成水或不反应等,则无明显现象,以此来解答.
解答 解:A、Cl2通入NaHCO3溶液中,有二氧化碳气体放出,故A不选;
B、CO2通入CaCl2溶液中,不反应,则没有明显现象,故B选;
C、NH3通入溶液中转化为氨水,与AlCl3反应生成氢氧化铝沉淀,现象明显,故C不选;
D、SO2通入Ba(NO3)2溶液中,生成硫酸钡白色沉淀,故D不选;
故选B.
点评 本题考查物质反应的现象,明确物质的性质及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.分子式为C6H12O2的有机物A,有香味.A在酸性条件下水解生成有机物B和C.B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮.则A.可能的结构有几种( )
| A. | 2 | B. | 5 | C. | 6 | D. | 多于6种 |
19.下列对如图所示实验装置的判断中正确的是( )
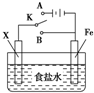

| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 | |
| B. | 若 X 为锌棒,开关 K 置于 A 或 B 处均可减缓铁的腐蚀 | |
| C. | 若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| D. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到铁棒附近先变红 |
16.下列关于各实验装置图的叙述中正确的是( )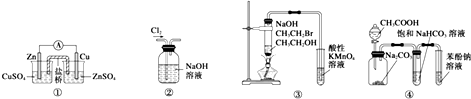

| A. | 装置①:构成锌-铜原电池 | |
| B. | 装置②:除去Cl2中含有的少量HCl | |
| C. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 装置③:验证溴乙烷发生消去反应生成烯烃 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1molNa2O2固体跟足量CO2气体完全反应,转移NA个电子 | |
| C. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| D. | 100mL 0.1mol/L盐酸中含HCl分子数为0.01NA |
13.化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2═2HCl推测:H2+Br2═2HBr.但类比是相对的,如根据2Na2O2+2CO2═2Na2CO3+O2,推测2Na2O2+2SO2═2Na2SO3+O2是错误的,应该是Na2O2+SO2═Na2SO4.
下列各组类比中正确的是( )
下列各组类比中正确的是( )
| A. | 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2 | |
| B. | 由CO2+Ca(ClO)2+H2O═CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O═CaSO3↓+2HClO | |
| C. | 铝和硫直接化合能得到Al2S3,推测:铁和硫直接化合也能得到 Fe2S3 | |
| D. | 由Na2CO3+2HCl═2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl═2NaCl+H2O+SO2↑ |
20.下列有关硫酸四氨合铜溶液的叙述正确的是( )
| A. | 该溶液中H+、NH4+、NO3-、Cl-可以大量共存 | |
| B. | Cu(NH3)4SO4中呈正四面体的原子团只有SO42- | |
| C. | 滴加Na2CO3溶液产生CuCO3蓝色沉淀 | |
| D. | 硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,其产生晶体的主要原理是CuSO4+4NH3═[Cu(NH3)4]SO4 |
17.已知某元素的一种原子可用符号AZX表示,则比其中子数大1的同位素原子的质子数是( )
| A. | Z | B. | A | C. | A+Z+1 | D. | A-Z+1 |
16.关于如图所示原电池的说法正确的是( )
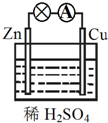

| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |