题目内容
16.关于如图所示原电池的说法正确的是( )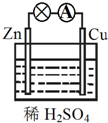
| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |
分析 该装置是将化学能转化为动能的装置,为原电池,Zn易失电子作负极、Cu作正极,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该装置是原电池,Zn易失电子发生氧化反应而作负极、Cu作正极,故A错误;
B.该装置是将化学能转化为电能的装置,为原电池,放电过程中有电流产生,故B正确;
C.负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,故C错误;
D.负极上失电子、正极上得电子,该装置中Zn是负极、Cu是正极,所以电子从Zn沿导线流向正极Cu,故D错误;
故选B.
点评 本题考查原电池原理,为高频考点,明确原电池概念、正负极判断、电子流向是解本题关键,注意电解质溶液中阴阳离子移动方向,电子不进入电解质溶液,为易错点.

练习册系列答案
相关题目
8.下列实验过程中,始终无明显现象的是( )
| A. | Cl2通入NaHCO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AlCl3溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
7.可逆反应发生下列变化,平衡一定正向移动的是( )
| A. | 正反应速率增大 | B. | 反应物浓度减小 | ||
| C. | K值减小 | D. | 正反应速率大于逆反应速率 |
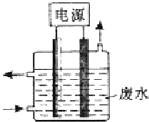
1.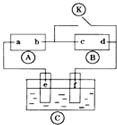 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,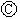 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现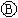 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通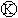 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 如图
如图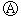 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | 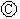 中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
8. 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
5.下列化学用语表示不正确的是( )
| A. | 亚硫酸在溶液中主要的电离方程式:H2SO3?H ++HSO3- | |
| B. | 用铁棒作阳极电解饱和氯化钠溶液的反应:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 热的纯碱溶液可以清洗油污的原因:CO32-+H2O?HCO3-+OH- | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe一2e-═Fe2+. |
6.下列有关物质的保存方法,不正确的是( )
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
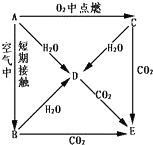 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.