题目内容
 原电池是化学对人类的一项重大贡献.
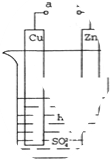
原电池是化学对人类的一项重大贡献.(1)如图所示,a和b用导线连接,Cu极为原电池
(2)将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池,
①通入
②负极的电极反应式是
③8g甲烷气体的燃烧生成液态水时放热445kJ,写出甲烷燃烧的热化学反应方程式
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)锌比铜活泼,形成原电池时锌为负极,铜为正极负极发生氧化反应,正极发生还原反应;
(2)燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应,根据一定质量的甲烷燃烧放出的热量可计算反应热,进而可写出热化学方程式,以此解答.
(2)燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应,根据一定质量的甲烷燃烧放出的热量可计算反应热,进而可写出热化学方程式,以此解答.
解答:
解:(1)锌比铜活泼,形成原电池时锌为负极,铜为正极负极发生氧化反应,正极发生还原反应,正极电极方程式为2H++2e-=H2↑,
故答案为:正;2H++2e-=H2↑;
(2)①通入O2电极反应式是:2O2+8e-+4H2O═8OH-,发生还原反应,为原电池的正极,故答案为:O2;
②通入CH4的一极,为原电池的负极,发生氧化反应,其电极反应式是:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
③n(CH4)=0.5mol,则1mol甲烷反应可放出890kJ热量,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1.
故答案为:正;2H++2e-=H2↑;
(2)①通入O2电极反应式是:2O2+8e-+4H2O═8OH-,发生还原反应,为原电池的正极,故答案为:O2;
②通入CH4的一极,为原电池的负极,发生氧化反应,其电极反应式是:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
③n(CH4)=0.5mol,则1mol甲烷反应可放出890kJ热量,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1.
点评:本题考查综合考查原电池知识,侧重电池工作原理以及热化学的考查,为高频考点,题目难度不大,注意把握电极反应式的书写,书写电极反应式时要结合电解质溶液的酸碱性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有关Fe及其化合物的部分转化关系如图所示.下列说法不正确的是( )


| A、混合气体X一定含有SO2 |
| B、②中试剂可以是氨水或NaOH溶液 |
| C、③中操作为蒸发浓缩、冷却结晶 |
| D、①中硫酸的浓度一定为98% |
实验室中可用KClO3来制备氧气.KClO3中Cl元素的化合价为( )
| A、+7 | B、+5 | C、+1 | D、-1 |
下列物质既含有离子键又含有共价键的是( )
| A、H2O |
| B、Na2O |
| C、NH4Cl |
| D、N2 |
 ;
;
 和
和 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为