题目内容
17.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )| A. | 1.2mol/(L•min) | B. | 1mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
分析 结合v=$\frac{△c}{△t}$计算.
解答 解:在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为$\frac{\frac{20mol-8mol}{10L}}{2min}$=0.6mol/(L•min),
故选C.
点评 本题考查反应速率的计算,为高频考点,把握速率计算公式为解答本题的关键,侧重分析与计算能力的考查,注意浓度变化量的判断,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
18.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Si→SiO2→H2SiO4→Na2SiO3 | B. | Fe→FeCl2→FeCl3→Fe(OH)3 | ||
| C. | Na→Na2CO2→Na2O2→NaOH | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
19.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?H++SO32-和HSO3-+H2OH2SO3+OH-,HSO3-的电离程度强于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(2)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(2)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
2.下列化学术语或表示方法错误的是( )
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: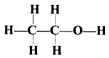 |
7.将下列物质分别加到湿的红色布条上,不能使其褪色是( )
| A. | 新制氯水 | B. | 液氯 | ||
| C. | 次氯酸钠溶液和HCl混合液 | D. | 氯化钙 |
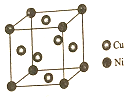 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: