题目内容
18.有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,C是一种两性元素;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:(1)写出有关元素的名称:A钠元素,C铝元素 .
(2)用电子式表示离子化合物A2B的形成过程:

(3)B与E两种元素除能形成常见的化合物E2B外,还能形成E2B2,该物质是一种常见的绿色氧化剂,该物质的化学式为H2O2.
(4)写出A2B2的电子式
 .
.(5)写出A的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+H2O.
分析 有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;D和E可形成4核10电子的分子为氨气,E为H,D为N元素;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30,则A为Na,B为O元素;A、C同周期,C是一种两性元素,C为Al,以此来解答.
解答 解:(1)由上述分析可知,A、C分别为钠元素、铝元素,故答案为:钠元素;铝元素;
(2)用电子式表示离子化合物A2B的形成过程为 ,
,
故答案为: ;
;
(3)B为O,E为H,则E2B2为H2O2,故答案为:H2O2;
(4)Na2O2为离子化合物,电子式为为 ,故答案为:
,故答案为: ;
;
(5)A的最高价氧化物的水化物为NaOH,C的最高价氧化物的水化物为氢氧化铝,二者反应的离子方程式OH-+Al(OH)3=AlO2-+H2O,
故答案为:OH-+Al(OH)3=AlO2-+H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构推断元素为解答本题的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
相关题目
19.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?H++SO32-和HSO3-+H2OH2SO3+OH-,HSO3-的电离程度强于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(2)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(2)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
13.1mol某金属与含3mol HNO3的稀硝酸恰好完全反应,则该金属可能是( )
| A. | Fe | B. | Al | C. | Cu | D. | Ag |
3.下列每组物质中化学键类型和分子的极性都相同的是( )
| A. | H2O和CH4 | B. | NaCl和HCl | C. | CO2和CS2 | D. | O2和HBr |
7.将下列物质分别加到湿的红色布条上,不能使其褪色是( )
| A. | 新制氯水 | B. | 液氯 | ||
| C. | 次氯酸钠溶液和HCl混合液 | D. | 氯化钙 |
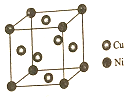 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: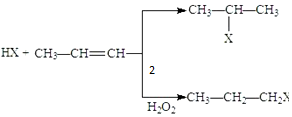 (X为卤素原子)
(X为卤素原子)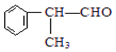 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$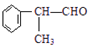
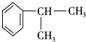 .
.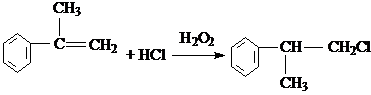 、2
、2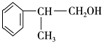 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2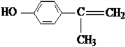 、
、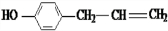 、
、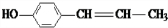 .
.