题目内容
6.有机化合物K在化工和医药方面有重要的应用,其合成路线如下:
已知信息:
①C能发生银镜反应,E的相对分子质量比D大4,G的苯环上的一溴代物有两种
②
 $→_{△}^{MnO_{4}/H+}$
$→_{△}^{MnO_{4}/H+}$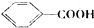
③2RCH2CHO$→_{△}^{NaOH}$
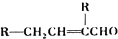
请回答下列问题:
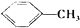
(1)F的名称是甲苯,H含有的官能团是羧基和氯原子.
(2)A→B的反应类型是加成反应,F→G的反应类型是取代反应.
(3)C与银氨溶液反应的化学方程式是
 .
.(4)K的结构简式是
 .
.(5)符合下列要求的C8H10O的同分异构体有9种.
①芳香族化合物②与Na反应并产生H2③遇FeCl3溶液呈紫色,
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是
 (写出其中一种结构简式)
(写出其中一种结构简式)(6)参照已知信息和成路线,设计一条由CH2=CH2为原料合成CH3CH2CH2CH2OH的路线(注明反应条件):
 .
.
分析 A发生加成反应生成B,B发生催化氧化反应生成C,C能发生银镜反应,则C为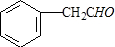 ,则B为
,则B为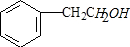 ,C发生信息③的反应,则D结构简式为
,C发生信息③的反应,则D结构简式为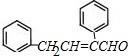 ,E的相对分子质量比D大4,则D发生碳碳双键和醛基的还原反应,则E结构简式为
,E的相对分子质量比D大4,则D发生碳碳双键和醛基的还原反应,则E结构简式为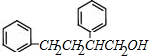 ;
;
F为 ,F发生苯环上的取代反应生成G,G的苯环上的一溴代物有两种,则G结构简式为
,F发生苯环上的取代反应生成G,G的苯环上的一溴代物有两种,则G结构简式为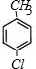 ,G被酸性高锰酸钾氧化生成H,则H结构简式为
,G被酸性高锰酸钾氧化生成H,则H结构简式为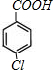 ,H和浓NaOH水溶液发生水解反应、中和反应然后酸化得到I,I结构简式为
,H和浓NaOH水溶液发生水解反应、中和反应然后酸化得到I,I结构简式为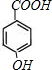 ,E和I发生酯化反应生成K,K结构简式为
,E和I发生酯化反应生成K,K结构简式为 ,
,
(6)CH2=CH2和H2O发生加成反应生成CH3CH2OH,CH3CH2OH发生催化氧化反应生成CH3CHO,CH3CHO在NaOH溶液中加热生成CH3CH=CHCHO,CH3CH=CHCHO和氢气发生加成反应生成CH3CH2CH2CH2OH,
据此分析解答.
解答 解:A发生加成反应生成B,B发生催化氧化反应生成C,C能发生银镜反应,则C为 ,则B为
,则B为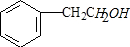 ,C发生信息③的反应,则D结构简式为
,C发生信息③的反应,则D结构简式为 ,E的相对分子质量比D大4,则D发生碳碳双键和醛基的还原反应,则E结构简式为
,E的相对分子质量比D大4,则D发生碳碳双键和醛基的还原反应,则E结构简式为 ;
;
F为 ,F发生苯环上的取代反应生成G,G的苯环上的一溴代物有两种,则G结构简式为
,F发生苯环上的取代反应生成G,G的苯环上的一溴代物有两种,则G结构简式为 ,G被酸性高锰酸钾氧化生成H,则H结构简式为
,G被酸性高锰酸钾氧化生成H,则H结构简式为 ,H和浓NaOH水溶液发生水解反应、中和反应然后酸化得到I,I结构简式为
,H和浓NaOH水溶液发生水解反应、中和反应然后酸化得到I,I结构简式为 ,E和I发生酯化反应生成K,K结构简式为
,E和I发生酯化反应生成K,K结构简式为 ,
,
(1)F为 ,F的名称是甲苯,H结构简式为
,F的名称是甲苯,H结构简式为 ,H含有的官能团是羧基和氯原子,
,H含有的官能团是羧基和氯原子,
故答案为:甲苯;羧基和氯原子;
(2)A→B的反应类型是加成反应,F→G的反应类型是取代反应,故答案为:加成反应;取代反应;
(3)C与银氨溶液反应的化学方程式是 ,
,
故答案为: ;
;
(4)K的结构简式是 ,故答案为:
,故答案为: ;
;
(5)C8H10O的不饱和度=$\frac{8×2+2-10}{2}$=4,C8H10O的同分异构体符合下列条件:
①芳香族化合物,说明含有苯环,苯环的不饱和度是4,所以侧链没有双键;
②与Na反应并产生H2,说明含有羟基;
③遇FeCl3溶液呈紫色,说明含有酚羟基,
如果取代基为-OH、-CH2CH3有邻间对3种;
如果取代基为-OH和两个-CH3,
如果两个-CH3位于邻位,有2种;
如果两个-CH3位于间位,有3种,
如果两个-CH3位于对位,有1种;
则符合条件的有9种;
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1,
符合条件的同分异构体结构简式为 ,
,
故答案为:9; ;
;
(6)CH2=CH2和H2O发生加成反应生成CH3CH2OH,CH3CH2OH发生催化氧化反应生成CH3CHO,CH3CHO在NaOH溶液中加热生成CH3CH=CHCHO,CH3CH=CHCHO和氢气发生加成反应生成CH3CH2CH2CH2OH,其合成路线为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断和有机合成,为高频考点,侧重考查学生分析推断及知识迁移能力,根据某些物质分子式、结构简式、反应条件结合题给信息进行推断,难点是有机合成路线的设计,根据原料、产物、官能团及其性质关系采用知识迁移方法进行设计,易错点是限制型同分异构体种类判断,题目难度中等.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案 某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集02、NO气体 | |
| B. | 利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体 | |
| C. | 利用I、Ⅲ装置可以比较H2S04、H2CO3和H2SiO3的酸性强弱 | |
| D. | 利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境 |
 利用微生物电池处理含乙酸钠和对氯酚
利用微生物电池处理含乙酸钠和对氯酚 的废水,工作原理如图所示.下列说法错误的是( )
的废水,工作原理如图所示.下列说法错误的是( )| A. | 电极b是正极 | B. | 质子从b极移向a极 | ||
| C. | 处理后的废水pH降低 | D. | a极的电极反应式: +2e-+H+═ +2e-+H+═ +Cl- +Cl- |
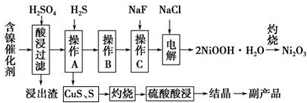 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
| A. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 | |
| B. | 给试管中的液体加热时要不时移动试管,以免暴沸 | |
| C. | 可用稀硝酸鉴别MgI、AgNO3、Na2CO3、NaAlO2四种溶液 | |
| D. | 稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中 |
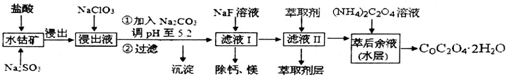
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如1图所示,在滤液Ⅱ中适宜萃取的pH为3.0~3.5左右.
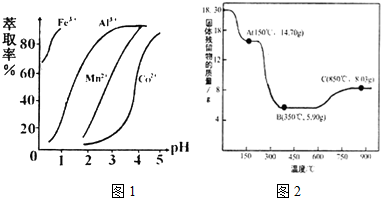
(6)已知:
NH3•H2O?NH4++OH- Kb=1.8×10-5
H2C2O4?H++H2CO4- K${\;}_{{a}_{1}}$=5.4×10-2
H2CO4-?H+C2O42- K${\;}_{{a}_{2}}$=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4.

| A. | 该反应可表示为:2A(g)+B(g)?C(g)△H<0 | |
| B. | t℃时该反应的平衡常数K=6.25 | |
| C. | 当容器中气体密度不再变化时,该反应达到平衡状态 | |
| D. | t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25 |
| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |