题目内容
17. 利用微生物电池处理含乙酸钠和对氯酚
利用微生物电池处理含乙酸钠和对氯酚 的废水,工作原理如图所示.下列说法错误的是( )
的废水,工作原理如图所示.下列说法错误的是( )| A. | 电极b是正极 | B. | 质子从b极移向a极 | ||
| C. | 处理后的废水pH降低 | D. | a极的电极反应式: +2e-+H+═ +2e-+H+═ +Cl- +Cl- |
分析 原电池工作时,正极上发生得电子的还原反应,负极上发生失电子的还原反应,a是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,b为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
-OH+Cl-,b为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
解答 解:A.a是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,b为负极,故A错误;
-OH+Cl-,b为负极,故A错误;
B.阳离子从负极移向正极,则H+从b极移向a极,故B正确;
C.由电极方程式可知当转移8mol电子时,正极消耗4molH+,负极生成7molH+,则处理后的废水pH降低,故C正确;
D.a是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,故D正确.
-OH+Cl-,故D正确.
故选A.
点评 本题考查新型电池,题目难度中等,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有关金属的腐蚀与保护的说法正确的是( )
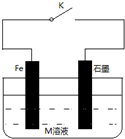

| A. | 常温下,关闭K时,若M溶液为浓硫酸,则石墨上有氢气放出 | |
| B. | 关闭K时,若M为氯化钠,则铁电极的电极反应式为:O2+4e-+2H2O═4OH- | |
| C. | 关闭K时,若M为则硫酸铵,则石墨极的电极反应式为:2H++2e-═H2↑ | |
| D. | 关闭K时,若M溶液为海水,石墨换成铜或银,则称为外加电流的阴极保护法 |
8. 常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.2 mol.L-1 |
5.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| B | 向AgI悬浊液中滴加NaCl溶液 | 不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 向KI溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈紫色 | I-还原性强于Cl- |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
2.化学与生产、生活密切相关.下列叙述错误的是( )
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒有害物质 | |
| B. | 在厨房里可用米汤检验加碘食盐中的碘 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
7. 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )| A. | a点:c( HCO3-)>c(Cl-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -) | |
| C. | c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Cl-)=c(Na+) |
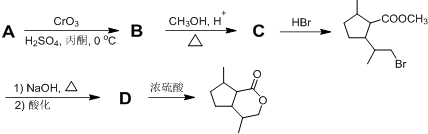
 ,B含有的官能团的名称是羧基、碳碳双键.
,B含有的官能团的名称是羧基、碳碳双键.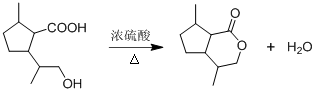 .
. ,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号).
,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号). ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上. 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
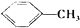 $→_{△}^{MnO_{4}/H+}$
$→_{△}^{MnO_{4}/H+}$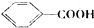
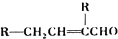
 .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式) .
.