题目内容
15.X、Y、Z、W是原子序数依次增大的短周期元素,X的一种原子没有中子,Y、Z易形成质量比为3:4和3:8的两种常见化合物,W所在的周期数和族序数相同.下列说法正确的是( )| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
分析 X、Y、Z、W是原子序数依次增大的短周期元素,X元素X的一种原子核内无中子,应为H元素;Y、Z易形成质量比为3:4和3:8的两种常见化合物,则形成两种化合物为YZ、YZ2,所以该常见化合物为CO、CO2,则Y为C元素,Z为O元素;W所在的周期数和族序数相同,而且原子序数大于O,所以W为Al元素;结合对应的化合物的性质以及元素周期律知识解答该题.
解答 解:X、Y、Z、W是原子序数依次增大的短周期元素,X元素X的一种原子核内无中子,应为H元素;Y、Z易形成质量比为3:4和3:8的两种常见化合物,则形成两种化合物为YZ、YZ2,所以该常见化合物为CO、CO2,则Y为C元素,Z为O元素;W所在的周期数和族序数相同,而且原子序数大于O,所以W为Al元素,
A.W为Al元素,其最高价氧化物对应水化物是两性氢氧化物,故A错误;
B.电子层数越多,原子半径越大,电子层相同时,原子序数越大,半径越小,所以原子半径:Z<Y<W,故B错误;
C.H、C可以形成既有极性键也有非极性键的化合物,如C2H6,故C正确;
D.原子最外层电子数:O>C>Al,即Y>Z>W,故D错误.
故选C.
点评 本题考查原子结构和元素性质,题目难度不大,涉及化学键、酸性强弱判断、原子半径的比较、元素周期律等知识点,正确判断元素是解本题关键,结合物质的结构性质解答.

练习册系列答案
相关题目
5.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| B | 向AgI悬浊液中滴加NaCl溶液 | 不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 向KI溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈紫色 | I-还原性强于Cl- |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
7. 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )| A. | a点:c( HCO3-)>c(Cl-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -) | |
| C. | c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Cl-)=c(Na+) |
17.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的非金属性强弱顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W和Z形成的物质中只含离子键 | |
| D. | 由Y形成的氢化物中可能是H2Y或YH3、YH4 |

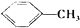 $→_{△}^{MnO_{4}/H+}$
$→_{△}^{MnO_{4}/H+}$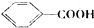
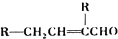
 .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式) .
.

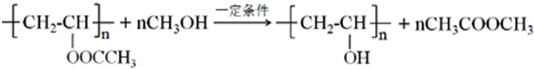
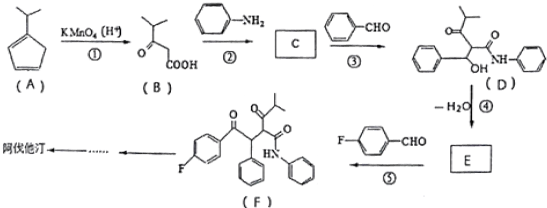
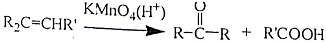 R、R′代表烃基)
R、R′代表烃基)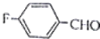 的名称对氟苯甲醛.
的名称对氟苯甲醛.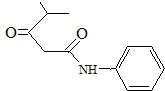 .
.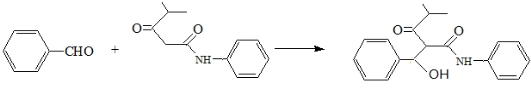 .
.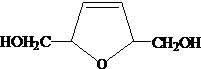 .
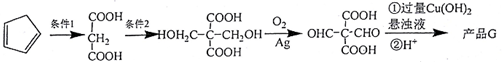
.
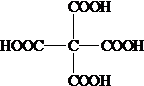 .
.

 ;
;