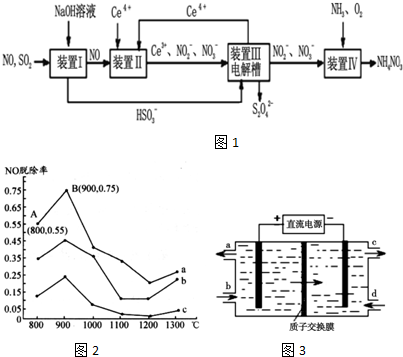
题目内容
18.固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )
| A. | 该反应可表示为:2A(g)+B(g)?C(g)△H<0 | |
| B. | t℃时该反应的平衡常数K=6.25 | |
| C. | 当容器中气体密度不再变化时,该反应达到平衡状态 | |
| D. | t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25 |
分析 A.根据反应物减小,生成物增加,变化的物质的量之比等于反应中计量数之比,写出化学方程式,根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应;
B.图I中5min时达到化学平衡,根据c=$\frac{n}{V}$平衡浓度,带入K表达式计算;
C.由$ρ=\frac{m}{V}$可知,m不变,V不变,则ρ是定值;
D.图I中5min时,C的体积分数为$\frac{0.2mol}{0.2mol+0.2mol+0.4mol}$=0.25,充入0.4 mol C,条件的改变大于平衡移动的改变.
解答 解:A.根据图可知A物质的量减小0.4mol,B物质的量减小0.2mol,A、B均为反应物,C物质的量增加0.2mol,为生成物,根据变化的物质的量之比等于反应中计量数之比,写出化学方程式为2A(g)+B(g)?C(g),根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应,所以热化学方程式为:2A(g)+B(g)?C(g)△H>0,故A错误;
B.图I中5min时达到化学平衡,平衡浓度分别为c(A)=$\frac{0.4mol}{2L}$=0.2mol/L,c(B)=$\frac{0.2mol}{2L}$=0.1mol/L、c(C)=$\frac{0.2mol}{2L}$=0.1mol/L,则K=$\frac{0.1mol/L}{0.1mol/L×(0.2mol/L)^{2}}$=25,故B错误;
C.由$ρ=\frac{m}{V}$可知,m不变,V不变,则ρ是定值,因此当容器中气体密度不再变化时,该反应不一定达到平衡状,故C错误;
D.图I中5min时,C的体积分数为$\frac{0.2mol}{0.2mol+0.2mol+0.4mol}$=0.25,充入0.4 mol C,虽平衡逆向移动,但C的体积分数增大,故D正确;
故选D.
点评 本题主要考查了化学反应速率的计算、热化学方程式的书写、影响平衡移动的因素等知识点,难度中等.

 常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.l mol.L-lHCl的溶液p 中逐滴加入0.2mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.2 mol.L-1 |
 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )| A. | a点:c( HCO3-)>c(Cl-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -) | |
| C. | c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Cl-)=c(Na+) |
| A. | KNO3 NaCl NaOH | B. | KOH Na2CO3 HCl | ||
| C. | KNO3 NaOH FeCl3 | D. | AgNO3 BaCl2 HNO3 |
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
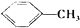 $→_{△}^{MnO_{4}/H+}$
$→_{△}^{MnO_{4}/H+}$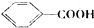
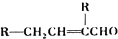
 .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式) .
. )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):



 .
. .
.